
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中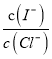 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJmol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】某物质只含C、H、O三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。

(1)该物质中含氧官能团的结构简式为________。
(2)下列物质中,与该物质互为同分异构体的是________(填序号)。
A.CH3CH2CH2COOH
B.OHCCH(CH3)CHO
C.CH3CH2CH===CHCOOH
D.CH2===CHCOOCH3
(3)该分子中共平面的原子数最多为________(已知羧基的四个原子可以共平面)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的轨道表示式为_________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是____________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___________。
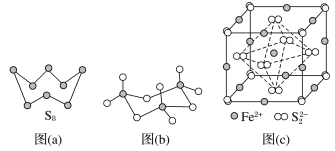
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为____________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为2 mol·L-1B.上述电解过程中共转移2 mol电子
C.电解得到的Cu的物质的量为0.5 molD.电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断正确的是
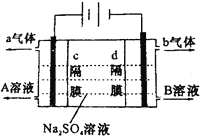
A.a气体为氢气,b气体为氧气
B.A溶液为氢氧化钠,B溶液为硫酸
C.c隔膜为阳离子交换膜、d隔膜为阴离子交换膜
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O![]() 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量A、B混合气体发生反应:aA(g)+bB(g)![]() cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
A. a+b=cB. 该变化使平衡正向移动
C. B的转化率降低D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M对霉菌有较好的抑制作用,结构简式为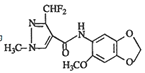 ,其合成路线如图所示:
,其合成路线如图所示:
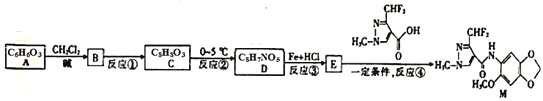
已知: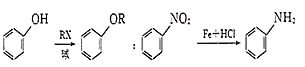
回答下列问题:
(1)化合物B的分子式为___;D中官能团的名称为__。
(2)反应②的反应类型是__。
(3)化合物E的结构简式为___。
(4)写出A与足量溴水反应的化学方程式:__。
(5)写出符合下列条件的D的同分异构体__(填结构简式,写出一种即可)。
①含有硝基和羰基,且分别和苯环直接相连;
②能与FeCl3溶液发生显色反应;
③核磁共振氢谱显示有3组峰,且峰面积之比为2:2:3。
(6)请以![]() 、
、![]() 为原料合成化合物
为原料合成化合物![]() ,写出制备的合成路线流程图。(无机试剂任用)__。
,写出制备的合成路线流程图。(无机试剂任用)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,位于周期表的_____区,基态原子价电子排布图为_______。
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有_______。
(3)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:Sm +ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为______, lmol CH2=CH2中含有的σ键数目为______。常温下l,2-二碘乙烷为液体而乙烷为气体,其主要原因是__________
(4)与N3-互为等电子体的分子有________________(写两个化学式)。
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。晶胞中Ce(铈)原子的配位数为_______,列式表示Ce(铈)单质的密度:________g/cm3(用NA表示阿伏伽德罗常数的值,不必计算出结果)
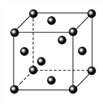
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示的装置对能量变化情况进行研究。当往试管中滴加试剂Y时,看到U形管中液面甲处下降、乙处上升。不符合要求的X、Y可能是( )
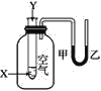
A.X是水,Y是浓硫酸
B.X是盐酸,Y是氢氧化钠溶液
C.X是硝酸铵固体,Y是水
D.X是铝粉,Y是稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com