
【题目】下列说法中正确的是
A.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率与平衡常数均增大
B.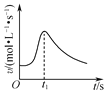 如图是镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高
如图是镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高
C.反应2HI(g)H2(g)+I2(g),达到平衡后,缩小容器容积可使体系颜色变深。该现象不能用勒夏特列原理解释
D.若反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)在常温下能自发进行,则该反应的ΔH>0
【答案】C
【解析】
A.浓硫酸作催化剂、吸水剂,加热可加快反应速率,但正反应为放热反应,加热,平衡逆向移动,则该反应的反应速率增大,而平衡常数减小,故A错误;
B.镁条与盐酸反应的化学反应速率随反应时间变化的曲线,开始时,反应放热,温度升高,反应速率加快,但随浓度减小,一段时间后反应速率减小,t1时刻溶液的温度不一定最高,故B错误;
C.对于2HI(g)H2(g)+I2(g),达平衡后,缩小容器体积,压强增大,平衡不移动,但I2浓度变大,颜色变深,该现象不能用勒夏特列原理解释,故C正确;
D.生成物只有固体,△S<0,若该反应能自发进行,根据△H-T△S<0,则△H必须小于0,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】如下图所示,装置(I)是一种可充电电池,装置(Ⅱ)为惰性电极的电解池。下列说法正确的是

A. 闭合开关K时,电极B为负极,且电极反应式为:2Brˉ-2eˉ=Br2
B. 装置(I)放电时,总反应为:2Na2S2+Br2=Na2S4+2NaBr
C. 装置(I)充电时,Na+从左到右通过阳离子交换膜
D. 该装置电路中有0.1moleˉ通过时,电极Ⅹ上析出3.2gCu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 X、Y、Z、W 原子序数依次增大,Y 与 W 同族。X、Y、Z 三种原子最外层电子数的关系 为 X+Z=Y。电解 Z 与 W 形成的化合物的水溶液,产生 W 元素的气体单质,此气体同冷烧碱溶液作 用,可得到化合物 ZWX 的溶液。下列说法正确的是
A.W 的氢化物稳定性强于 Y 的氢化物
B.Z与其他三种元素分别形成的化合物中只含有离子键
C.Z 与 Y 形成的化合物的水溶液呈碱性
D.对应的简单离子半径大小为 W >Z > X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)在2 L的密闭容器中进行,半分钟后N2的物质的量增加了0.60 mol。则下列选项中反应的平均速率正确的为
A.v(O2)=0.90 mol·L-1·min-1B.v(NH3)=0.04 mol·L-1·s-1
C.v(N2)=0.02 mol·L-1·s-1D.v(H2O)=1.20 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水垢中含有的 CaSO4,可先用 Na2CO3 溶液处理,使之转化为疏松、易溶于酸的 CaCO3。某化学兴 趣小组用某浓度的 Na2CO3 溶液处理一定量的 CaSO4 固体,测得所加 Na2CO3 溶液体积与溶液中-lgc(CO32-) 的关系如图所示,已知Ksp(CaSO4)=9×10-6,Ksp(CaCO3)=3×10-9,lg3=0.5,下列说法不正确的是
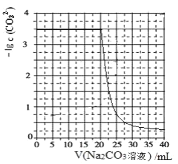
A.曲线上各点的溶液满足关系式:c(Ca2+)×c(SO42-)=Ksp(CaSO4)
B.CaSO4(s)+CO32-(aq) ![]() CaCO3(s)+SO42-(aq) K=3×103
CaCO3(s)+SO42-(aq) K=3×103
C.该Na2CO3溶液的浓度为1.5mol·L-1
D.相同条件下,若将Na2CO3溶液的浓度改为原浓度的2倍,则上图曲线整体向上平移1个单位即可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以AgZSM为催化剂,在容积为1 L的容器中,相同时间下测得0.1 mol NO转化为N2的转化率随温度变化如图所示[无CO时反应为2NO(g)![]() N2(g)+O2(g);有CO时反应为2CO(g)+2NO(g)
N2(g)+O2(g);有CO时反应为2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)]。下列说法正确的是 ( )
2CO2(g)+N2(g)]。下列说法正确的是 ( )

A.反应2NO![]() N2+O2的ΔH>0
N2+O2的ΔH>0
B.达平衡后,其他条件不变,使n(CO)/n(NO)>1,CO转化率下降
C.X点可以通过更换高效催化剂提高NO转化率
D.Y点再通入CO、N2各0.01 mol,此时v(CO,正)<v(CO,逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化。为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应C(s)+CO2(g)2CO(g) ΔH,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
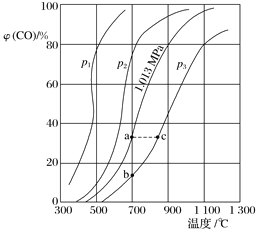
(1)p1、p2、p3的大小关系是_______,欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为___________________。图中a、b、c三点对应的平衡常数(用Ka、Kb和Kc表示)大小关系是____________________;
(2)900 ℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V,CO2的转化率为__________,该反应的平衡常数K=________________。
(3)将(2)中平衡体系温度降至640 ℃,压强降至0.101 3 MPa,重新达到平衡后CO2的体积分数为50%。条件改变时,正反应和逆反应速率如何变化?_________________,二者之间有何关系?__________________。
(4)CO2催化加氢也可转化为CO,但同时会合成二甲醚,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=41.2 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图
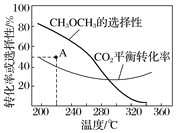
其中:CH3OCH3的选择性=![]() ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是___________;
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________________。
(5)水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
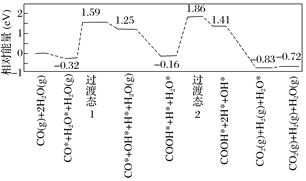
可知水煤气变换的ΔH_______0(填“大于”、“等于”或“小于”)。该历程中最大能垒(活化能)E正=_______eV,写出该步骤的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为![]() )为原料制备氯化铁晶体(
)为原料制备氯化铁晶体(![]() )的工艺流程如下所示:
)的工艺流程如下所示:

下列说法不正确的是
A. “酸溶”过程中使用的酸也可以是硝酸
B. 为防止污染,“焙烧”过程中产生的![]() 应回收利用
应回收利用
C. 通入氯气的目的是氧化![]()
D. 用![]() 制取无水
制取无水![]() 时,需要在氯化氢气流中加热
时,需要在氯化氢气流中加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-丁炔的结构简式是____________,它与过量溴加成后产物的名称是_________;有机物A的分子式与1-丁炔相同,而且属于同一类别,A与过量溴加成后产物的名称是_______;与1-丁炔属于同系物的且所含碳原子数最少的有机物是______,它能发生_______反应填反应类别制成导电塑料![]() ,这是21世纪具有广阔前景的合成材料。
,这是21世纪具有广阔前景的合成材料。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com