
【题目】某科学研究小组制备硝基苯的实验装置如图所示,相关数据见下表。已知该实验中存在的主要副反应是:在温度稍高的情况下会生成间二硝基苯。
物质 | 熔点/℃ | 沸点/℃ | 密度/( | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
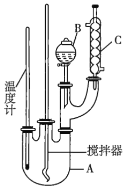
实验步骤如下:
取![]() 浓硫酸与足量浓硝酸配制成混合酸,将混合酸小心加入
浓硫酸与足量浓硝酸配制成混合酸,将混合酸小心加入![]() 中。取
中。取![]() 苯加入
苯加入![]() 中。在室温下,向苯中逐滴加入混合酸,边滴加边搅拌,混合均匀加热,使其在/span>50~60℃下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、
中。在室温下,向苯中逐滴加入混合酸,边滴加边搅拌,混合均匀加热,使其在/span>50~60℃下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、![]() 溶液和水洗涤。在分出的产物中加入无水
溶液和水洗涤。在分出的产物中加入无水![]() 颗粒,静置片刻,过滤,对滤液进行蒸馏纯化,收集205~210℃的馏分,得到纯硝基苯
颗粒,静置片刻,过滤,对滤液进行蒸馏纯化,收集205~210℃的馏分,得到纯硝基苯![]() 。
。
回答下列问题:
(1)图中装置![]() 的作用是______。
的作用是______。
(2)制备硝基苯的化学反应方程式为___________。
(3)配制混合酸时,能否将浓硝酸加入到浓硫酸中?_____(填“能”或“不能”),说明理由:_______。
(4)为了使反应在50-60 ℃下进行,常采用的加热方法是_____。反应结束并冷却至室温后![]() 中液体为粗硝基苯,粗硝基苯呈黄色的原因是_________。
中液体为粗硝基苯,粗硝基苯呈黄色的原因是_________。
(5)在洗涤操作中,第二次水洗的目的是____。
(6)本实验所得到的硝基苯的产率是_______。
【答案】冷凝回流 ![]() +HO-NO2
+HO-NO2 ![]() +H2O 不能 浓硝酸与浓硫酸混合时会放出大量的热,若将浓硝酸加入浓硫酸中,浓硝酸的密度小于浓硫酸,容易导致液体迸溅 水浴加热 粗硝基苯中溶有浓硝酸分解产生的
+H2O 不能 浓硝酸与浓硫酸混合时会放出大量的热,若将浓硝酸加入浓硫酸中,浓硝酸的密度小于浓硫酸,容易导致液体迸溅 水浴加热 粗硝基苯中溶有浓硝酸分解产生的![]() 洗去残留的
洗去残留的![]() 及生成的钠盐 72%
及生成的钠盐 72%
【解析】
(1)由仪器结构特征可知,装置B为分液漏斗,装置C为冷凝管,苯与浓硝酸都可以挥发,装置C起冷凝回流的作用,以提高原料利用率。
(2)制备硝基苯的化学反应方程式为![]() +HO-NO2
+HO-NO2 ![]() +H2O。
+H2O。
(3)配制混合酸时,不能将浓硝酸加入到浓硫酸中。因为浓硝酸密度小于浓硫酸,且浓硝酸与浓硫酸混合时会放出大量的热,若将浓硝酸加入浓硫酸中,容易导致液体迸溅。
(4)反应在50~60℃下进行,苯及浓硝酸的沸点均低于水的沸点,可以采用水浴加热,受热均匀,且便于控制温度。粗硝基苯呈黄色的原因是粗硝基苯中溶有浓硝酸分解产生的![]() 。
。
(5)先用水洗除去浓硫酸、浓硝酸,再用![]() 溶液除去溶解的少量的酸,最后水洗除去未反应的NaOH及生成的钠盐。
溶液除去溶解的少量的酸,最后水洗除去未反应的NaOH及生成的钠盐。
(6)苯完全反应生成硝基苯的理论产量为![]() ,故硝基苯的产率为
,故硝基苯的产率为![]() 。
。


科目:高中化学 来源: 题型:
【题目】氨氮废水是生活中常见污染物之一,可用电解法加以去除。实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl混合溶液来模拟该过程。
(1)电解处理氨氮废水电解过程中,溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示:
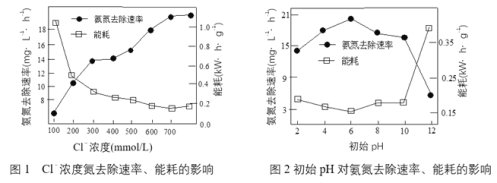
①根据图中数据,处理废水合适的条件是_______________。
②实验中发现阳极会持续产生细小气泡,气泡上浮过程中又迅速消失。结合图1,用电极反应式和离子方程式解释Cl-去除氨氮的原因_______________。
③图1中当Cl-浓度较低时、图2中当初始pH达到12时,均出现氨氮去除速率低而能耗高的现象,共同原因是_______________。
(2)氨的定量测定使用下图装置检测废水中的氨氮总量是否合格。
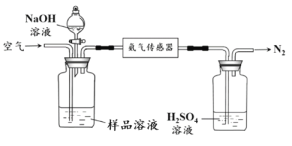
①利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:_______________。
②若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol,则样品混合液中氨氮(以氨气计)含量为_______________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种新型热激活电池的结构如图所示,电极a的材料是氧化石墨烯(CP)和铂纳米粒子,电极b的材料是聚苯胺(PANI),电解质溶液中含有Fe3+和Fe2+。加热使电池工作时电极b发生的反应是PANI-2e-=PANIO(氧化态聚苯胺,绝缘体)+2H+,电池冷却时Fe2+在电极b表面与PANIO反应可使电池再生。下列说法不正确的是
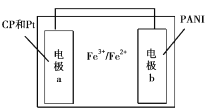
A.电池工作时电极a为正极,且发生的反应是:Fe3++e-—Fe2+
B.电池工作时,若在电极b周围滴加几滴紫色石蕊试液,电极b周围慢慢变红
C.电池冷却时,若该装置正负极间接有电流表或检流计,指针会发生偏转
D.电池冷却过程中发生的反应是:2Fe2++PANIO+2H+=2Fe3++ PANI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,由于石油价格的不断上涨,以煤为原料制备一些化工产品的前景又被看好。下图是以煤为原料生产聚乙烯(PVC)和人造羊毛的合成线路。
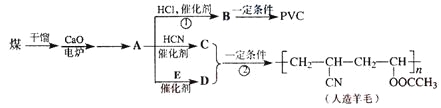
请回答下列问题:
(1)写出反应类型:反应①______________,反应②__________________。
(2)写出结构简式:PVC________________,C______________________。
(3)写出A![]() D的化学方程式_______________________________。
D的化学方程式_______________________________。
(4)与D互为同分异构体且可发生碱性水解的物质有________种(不包括环状化合物),写出其中一种的结构简式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H12的苯的同系物,已知苯环上只有一个取代基,下列说法中正确的是 ( )
A. 该有机物能发生加成反应,但不能发生取代反应
B. 该有机物不能使酸性高锰酸钾溶液和溴水褪色
C. 该有机物分子中的所有原子不可能在同一平面上
D. 该有机物的一溴代物最多有5种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和结论错误的是( )
A.用新制![]() 悬浊液可鉴别麦芽糖和蔗糖
悬浊液可鉴别麦芽糖和蔗糖
B.用银镜反应可证明淀粉是否水解为葡萄糖,但不能证明其是否完全水解
C.浓硫酸可使蔗糖变黑,证明浓硫酸具有脱水性
D.向蔗糖溶液中滴加几滴稀硫酸后,水浴加热几分钟,将混合液再加入到银氨溶液中,不能发生银镜反应,则证明蔗糖没有发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铁作阳极,利用电解原理可使废水中的污染物凝聚而分离,其工作原理如图所示。下列说法错误的是( )
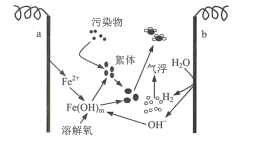
A.电极b为阴极
B.a极的电极反应式:Fe-2e-=Fe2+
C.处理废水时,溶液中可能发生反应:4Fe2++O2+8OH-+2H2O=4Fe(OH)3
D.电路中每转移3 mol电子,生成1 mol Fe(OH)3胶粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如下图所示,其中如图为反应①过程中能量变化的曲线图。
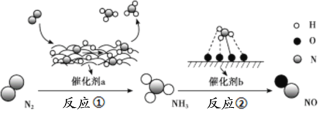
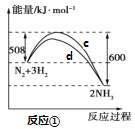
下列分析合理的是
A.如图中c曲线是加入催化剂a时的能量变化曲线
B.反应①的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
C.在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L
D.催化剂a、b能提高化学反应①、②的化学反应速率和平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
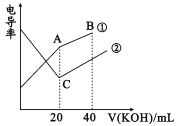
A. B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
B. A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-14
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com