
【题目】将下列各组物质按酸、碱、盐分类依次排列,正确的是( )
A.硫酸、纯碱、小苏打
B.磷酸、熟石灰、苛性钠
C.硫酸氢钠、生石灰、醋酸钠
D.硫酸、烧碱、胆矾
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)下列物质: ①Cu ②SO2③冰醋酸④NaHCO3⑤Cu(OH )2⑥ H2SO4溶液⑦NaCl,属于非电解质的是____________(填序号),属于强电解质的是_______(填序号)。
(2)写出NaHCO3水解的离子方程式:______________________。
(3)已知Ksp[Cu(OH)2]=2×10-20,常温下某CuSO4溶液里,c(Cu2+)=2.0 mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于_______。
(4)现有25℃、pH=1的H2SO4溶液,该溶液的物质的量浓度为______,溶液中由水电离出的c(OH-)=_____。
(5)电解饱和食盐水溶液时,电极上生成了气体A 和B,气体B是____(填化学式);从阴极析出1.42L气体A,从阳极析出________L气体B(在标准状况下)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:
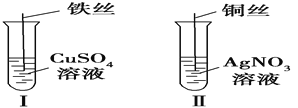
①Ⅰ中发生反应的离子方程式为___________________________________;
②Ⅱ中铜丝上观察到的现象是______________________________________
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为__________。
(2)将少量Cl2通入FeCl2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,这个事实说明具有还原性的粒子还原性强弱为___________________
(3) NaHCO3溶液与足量澄清石灰水反应的离子方程式_____________________________
(4)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。
①写出反应方程式并标出电子转移方向及数目______________________________________
②若反应方程式中转移了0.3 mol电子,则氧化产物的质量是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )

A. 正极反应式为![]()
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 若用该电池给铅蓄电池充电,MnO2电极质量减少8.7g,则铅蓄电池负极增重9.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品1L,进行了三组实验,其操作和有关图像如下所示:

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是__________,一定存在的阳离子是___________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为______,所得沉淀的最大质量是______g。
(4)若通过实验确定原废水中c(Na+)=0.18 mol·L-1,试判断原废水中NO3-是否存在?____(填“存在”“不存在”或“不确定”)。若存在, c(NO3-) = _____ mol·L-1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为___________(用名称表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式:___________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是______________。
① 硫酸铝和氢氧化钠 ② 硫酸锌和氢氧化钠 ③硫酸铝和氨水 ④ 硫酸锌和氨水
(4)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另一种耐高温的物质,写出该反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:

(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________、B的俗名____________;
②反应II的离子方程式是__________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应II的离子方程式是_____________________________;
②反应Ⅲ的离子方程式是_____________________________;
③检验B中阳离子最好的方法是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物脱H2S的原理为:
反应1:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
反应2:4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,氧化速率随温度和pH变化如下图。下列说法正确的是

A. 该过程最终将H2S转化为Fe2(SO4)3
B. H+是反应2的反应物,c(H+)越大反应速率越快
C. 反应1消耗11.2LH2S,转移的电子数目约为6.0×1023个
D. 反应温度过高,Fe2+氧化速率下降,其原因可能是硫感菌失去活性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com