
【题目】(1)下列物质: ①Cu ②SO2③冰醋酸④NaHCO3⑤Cu(OH )2⑥ H2SO4溶液⑦NaCl,属于非电解质的是____________(填序号),属于强电解质的是_______(填序号)。
(2)写出NaHCO3水解的离子方程式:______________________。
(3)已知Ksp[Cu(OH)2]=2×10-20,常温下某CuSO4溶液里,c(Cu2+)=2.0 mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于_______。
(4)现有25℃、pH=1的H2SO4溶液,该溶液的物质的量浓度为______,溶液中由水电离出的c(OH-)=_____。
(5)电解饱和食盐水溶液时,电极上生成了气体A 和B,气体B是____(填化学式);从阴极析出1.42L气体A,从阳极析出________L气体B(在标准状况下)。

【答案】 ② ④⑦ HCO3-+H2O![]() H2CO3+OH- 4 0.05 mol·L-1 1×10-13 mol·L-1 Cl2 1.42
H2CO3+OH- 4 0.05 mol·L-1 1×10-13 mol·L-1 Cl2 1.42
【解析】(1)本题考查强弱电解质、电解质和非电解质,非电解质:在水溶液或熔融状态都不能导电的化合物,属于非电解质的是②,强电解质包括强酸、强碱、多数的盐,因此属于强电解质的是④⑦;(2)考查水解方程式的书写,HCO3-属于弱酸根,发生水解,其水解方程式为HCO3-+H2O ![]() H2CO3+OH-;(3)本题考查溶度积的计算,根据Ksp=c(Cu2+)×c2(OH-),求出此时c(OH-)=1×10-10mol/L,即c(H+)=Kw/c(OH-)=10-4mol·L-1,即当pH=4时,此时的溶液为饱和氢氧化铜溶液,即当pH>4时,出现沉淀;(4)本题考查水的离子积的计算,pH=1推出溶液中c(H+)=0.1mol·L-1,即c(H2SO4)=0.1/2mol·L-1=0.05mol·L-1,水的离子积适合于稀溶液,即硫酸中水电离的c(OH-)=Kw/c(H+)=10-14/10-1mol·L-1=10-13mol·L-1;(5)考查电解原理,以及电解的计算,根据电解原理,阳极上Cl-先放电,阳极反应式为2Cl--2e-=Cl2↑,气体B为Cl2,阴极反应式为2H++2e-=H2↑,因此建立关系式为H2~2e-~Cl2,V(H2)=v(Cl2)=1.42L。
H2CO3+OH-;(3)本题考查溶度积的计算,根据Ksp=c(Cu2+)×c2(OH-),求出此时c(OH-)=1×10-10mol/L,即c(H+)=Kw/c(OH-)=10-4mol·L-1,即当pH=4时,此时的溶液为饱和氢氧化铜溶液,即当pH>4时,出现沉淀;(4)本题考查水的离子积的计算,pH=1推出溶液中c(H+)=0.1mol·L-1,即c(H2SO4)=0.1/2mol·L-1=0.05mol·L-1,水的离子积适合于稀溶液,即硫酸中水电离的c(OH-)=Kw/c(H+)=10-14/10-1mol·L-1=10-13mol·L-1;(5)考查电解原理,以及电解的计算,根据电解原理,阳极上Cl-先放电,阳极反应式为2Cl--2e-=Cl2↑,气体B为Cl2,阴极反应式为2H++2e-=H2↑,因此建立关系式为H2~2e-~Cl2,V(H2)=v(Cl2)=1.42L。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】有下列仪器:铁架台、铁圈、铁夹、三脚架、石棉网、烧杯、普通漏斗、冷凝管、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、牛角管、锥形瓶、温度计、坩埚钳、火柴、滤纸,从缺少必要的仪器和用品的角度考虑,不能进行的分离操作是( )
A.蒸发B.蒸馏C.过滤D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分离和提纯的方法中正确的是( )
A.除去Cl2的HCl气体可以通过浓硫酸
B.碳酸钠固体中的碳酸氢钠杂质可以通过加热除去
C.SO2可以通过碱石灰干燥
D.FeCl3溶液中含有CuCl2可以加入足量NaOH溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、硫、氮的化合物在工业上用途非常广泛。
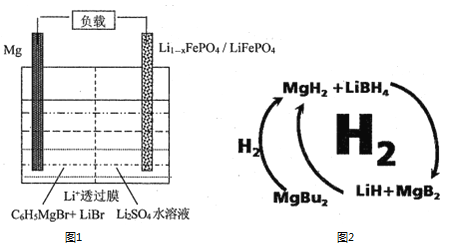
(1)一种镁—锂双离子二次电池的装置如图1所示。
①放电时,Mg电极为_____(填“正极”或“负极”)。
②充电时,Li+迁移至_____________(填“阳极区”或“阴极区”)。
(2)纳米MgH2和LiBH4组成的体系如图2所示,400℃以上受热放氢时发生反应的化学方程式为_____________________________________________。
(3)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:
2NO(g)+4H2(g)+O2(g)==N2(g)+4H2O(g) △H =-1143kJ·mol-1
2H2(g)+ O2(g)==2H2O(g) △H =-484kJ·mol-1
则2NO(g)+2H2(g)==N2(g)+2H2O(g) △H =____kJ·mol-1
(4)在一定条件下,反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
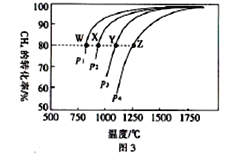
①图中p1、p2、p3、p4代表不同压强,压强最大的是_______。该反应的△H___(填“>”“<”“=”下同)0。
②压强为p4时,在Y点:v(正)__________v(逆)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ·mol-1。现在一容积为2L的密闭容器中充入2molSO2、1molO2,加入固体催化剂,保持温度在450℃使之发生反应,5min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
2SO3(g) △H=-196kJ·mol-1。现在一容积为2L的密闭容器中充入2molSO2、1molO2,加入固体催化剂,保持温度在450℃使之发生反应,5min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A. SO2的转化率为30%
B. 反应共放出了196.6kJ的热量
C. 用SO2表示的5min内的平均反应速率为0.36mol·L-1·min-1
D. 平衡时SO3的浓度是0.9mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是( )
A.用25 mL量筒量取4.0 mol/L的盐酸5.62 mL
B.做蒸馏操作时,冷凝水方向是下进上出
C.用溶解、过滤、蒸发的方法分离氯化钠与硝酸钾的混合物
D.用蒸发皿灼烧胆矾(CuSO45H2O)得到CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、Fe3O4、Fe2O3、FeO的混合物中加入200 mL 1 mol·L-1的盐酸,恰好使混合物完全反应溶解,放出4.48 mL(标准状况)气体。所得溶液中,加入KSCN溶液无红色出现,那么用足量的CO在高温下还原相同质量的此混合物,得到铁的质量为
A. 11.2 g B. 5.6 g C. 2.8 g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一带一路”为中国化工企业开辟了新的国际市场,其中,能源、资源整合和环境治理是保驾护航的基础。
I:利用太阳能促进燃料循环使用的原理如图所示,其中过程ⅰ的主要反应如下:

①2CO2(g)![]() 2CO(g)+O2(g) △H1
2CO(g)+O2(g) △H1
②2CO2(g)+4H2O(1) ![]() 2CH3OH(l)+3O2(g)
2CH3OH(l)+3O2(g)
③2H2O![]() 2H2+O2
2H2+O2
④___N2+____![]() NH3+____
NH3+____
⑤CO2+2H2O![]() CH4+2O2
CH4+2O2
(1)反应①的△H______0(填“<”、“>”或“=”)。
(2)下列对过程i、ⅱ的描述中正确的是______。
a.过程i、ⅱ中能量转化形式是:太阳能→化学能→热能
b.经过上述一个循环后不会产生新物质
c.经过上述一个循环后放出O2
(3)将反应④补充完整___N2+____![]() NH3+____
NH3+____
Ⅱ:SO2和NOx是主要大气污染物,利用下图装置可同时吸收SO2和NO。

(4)①a是直流电源的_______极。
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为:__________。
③用离子方程式表示吸收NO的原理____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质按酸、碱、盐分类依次排列,正确的是( )
A.硫酸、纯碱、小苏打
B.磷酸、熟石灰、苛性钠
C.硫酸氢钠、生石灰、醋酸钠
D.硫酸、烧碱、胆矾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com