
【题目】“一带一路”为中国化工企业开辟了新的国际市场,其中,能源、资源整合和环境治理是保驾护航的基础。
I:利用太阳能促进燃料循环使用的原理如图所示,其中过程ⅰ的主要反应如下:

①2CO2(g)![]() 2CO(g)+O2(g) △H1
2CO(g)+O2(g) △H1
②2CO2(g)+4H2O(1) ![]() 2CH3OH(l)+3O2(g)
2CH3OH(l)+3O2(g)
③2H2O![]() 2H2+O2
2H2+O2
④___N2+____![]() NH3+____
NH3+____
⑤CO2+2H2O![]() CH4+2O2
CH4+2O2
(1)反应①的△H______0(填“<”、“>”或“=”)。
(2)下列对过程i、ⅱ的描述中正确的是______。
a.过程i、ⅱ中能量转化形式是:太阳能→化学能→热能
b.经过上述一个循环后不会产生新物质
c.经过上述一个循环后放出O2
(3)将反应④补充完整___N2+____![]() NH3+____
NH3+____
Ⅱ:SO2和NOx是主要大气污染物,利用下图装置可同时吸收SO2和NO。

(4)①a是直流电源的_______极。
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为:__________。
③用离子方程式表示吸收NO的原理____________。
【答案】 > ab 2 6 H2O 4 3O2 负 2HSO3-+2H++2e-=S2O42-+2H2O 2NO+2HSO3-+2H2O=N2+4HSO3-
【解析】I:由题意知,过程i是利用太阳能对燃料及氧气进行再生、过程ⅱ是燃料的燃烧,两个过程是完全相反的反应方向,理论上,可以通过两个过程可以利用太阳能无限循环。
(1)反应①是CO燃烧的逆反应,故其△H>0。
(2) a.过程i、ⅱ中能量转化形式是:太阳能→化学能→热能,正确;b.经过上述一个循环后不会产生新物质,正确;c.经过上述一个循环后没有放出O2,该说法错误。综上所述,对过程i、ⅱ的描述中正确的是ab。
(3)反应④的化学方程式为2N2+6 H2O![]() 4 NH3+3O2。
4 NH3+3O2。
Ⅱ:由图中信息可知,在与a相连的电极上,HSO3-被还原为S2O42-,所以a电极为电源的负极、b为正极。
(4)①a是直流电源的负极。②已知电解池的阴极室中溶液的pH在4~7之间,溶液显酸性,所以阴极的电极反应为2HSO3-+2H++2e-=S2O42-+2H2O。③吸收NO的原理是,NO与S2O42-反应生成氮气和HSO3-,离子方程式为2NO+2HSO3-+2H2O=N2+4HSO3-。


科目:高中化学 来源: 题型:
【题目】常温下能大量共存的无色透明离子组是( )
A.K+、Na+、NO3-、MnO4-B.NH4+、CH3COO-、Ca2+、Cl-
C.OH-、Na+、Br-、HCO3-D.H+、Ba2+、Fe2+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质: ①Cu ②SO2③冰醋酸④NaHCO3⑤Cu(OH )2⑥ H2SO4溶液⑦NaCl,属于非电解质的是____________(填序号),属于强电解质的是_______(填序号)。
(2)写出NaHCO3水解的离子方程式:______________________。
(3)已知Ksp[Cu(OH)2]=2×10-20,常温下某CuSO4溶液里,c(Cu2+)=2.0 mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于_______。
(4)现有25℃、pH=1的H2SO4溶液,该溶液的物质的量浓度为______,溶液中由水电离出的c(OH-)=_____。
(5)电解饱和食盐水溶液时,电极上生成了气体A 和B,气体B是____(填化学式);从阴极析出1.42L气体A,从阳极析出________L气体B(在标准状况下)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照物质的树状分类和交叉分类,HNO3属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸 ⑥一元酸 ⑦化合物 ⑧混合物
A.①②③④⑤⑥⑦
B.①④⑥⑦
C.①⑧
D.①④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2与N2O4可相互转化:2NO2(g)![]() N2O4(g) △H=-57.2kJ/mol,将一定量NO2和N2O4的混合气体充入2L的恒温密闭容器中,各组分物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是
N2O4(g) △H=-57.2kJ/mol,将一定量NO2和N2O4的混合气体充入2L的恒温密闭容器中,各组分物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是

A. 前10min内,用v(NO2)表示的化学反应速率为0.04mol·L-1·min-1
B. 反应进行到10min时,反应物的转化率约为33.3%
C. a点正反应速率小于逆反应速率
D. 25min时,改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多巴胺的一种合成路线如下图所示

下列说法正确的是
A. 原料甲与苯酚互为同系物 B. 中间产物乙、丙和多巴胺都具有两性
C. 多巴胺不可能存在氨基酸类的同分异构体 D. 1mol 甲最多可以和2 mol Br2发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:
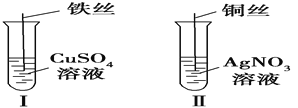
①Ⅰ中发生反应的离子方程式为___________________________________;
②Ⅱ中铜丝上观察到的现象是______________________________________
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为__________。
(2)将少量Cl2通入FeCl2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,这个事实说明具有还原性的粒子还原性强弱为___________________
(3) NaHCO3溶液与足量澄清石灰水反应的离子方程式_____________________________
(4)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。
①写出反应方程式并标出电子转移方向及数目______________________________________
②若反应方程式中转移了0.3 mol电子,则氧化产物的质量是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )

A. 正极反应式为![]()
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 若用该电池给铅蓄电池充电,MnO2电极质量减少8.7g,则铅蓄电池负极增重9.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:

(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________、B的俗名____________;
②反应II的离子方程式是__________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应II的离子方程式是_____________________________;
②反应Ⅲ的离子方程式是_____________________________;
③检验B中阳离子最好的方法是_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com