
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
分析 (1)锌较活泼,可与硫酸铜、硫酸等发生置换反应;
(2)硫酸铜溶液加快氢气生成的速率,原因是形成原电池;
(3)在几种溶液中,只有银能被锌置换出来;
(4)①为保证实验有对比性,只能逐渐改变一个变量分析,CuSO4溶液体积逐渐增多,故H2SO4的量应相等均为30mL,水的量减小,但每组实验中CuSO4与水的体积之和应相等;
②锌与硫酸反应使锌的表面凹凸不平,有很多细小的锌的颗粒,由于颗粒很小,光被完全吸收,所以看到的固体是灰黑色;Zn能够置换出Cu,出现紫红色;
③生成的单质Cu会沉积在Zn的表面,影响了反应速率.
解答 解:(1)因为Cu2+的氧化性比H+的强,所以加入硫酸铜,Zn先跟硫酸铜反应,反应完后再与酸反应,反应的有关方程式为Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,置换出铜,与锌形成原电池反应,化学反应速率加快,
故答案为:CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn-稀硫酸原电池,加快了氢气产生的速率;
(3)在几种溶液中,只有银能被锌置换出来,所以与CuSO4溶液起相似作用的是Ag2SO4溶液,
故答案为:Ag2SO4;
(4)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=10ml,V9=17.5ml,V1=30ml.
故答案为:30;10;17.5;
②A中没有加入硫酸铜,锌与稀硫酸反应后,锌的表面凹凸不平,有很多细小的锌的颗粒,由于颗粒很小,光被完全吸收,所以看到的固体是灰黑色;Zn能够置换出Cu附着在Zn表面,金属变为紫红色,
故答案为:灰黑色;紫红色;
③因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
故答案为:当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
点评 本题考查了影响化学反应速率的因素,并且融合了化学实验,形式新颖灵活,本题的易错点在于第(4)小题,首先V1、V6、V9的求得要注意分析表中数据;最后一问应该能够想到“覆盖”的问题,题目难度中等.


科目:高中化学 来源: 题型:填空题
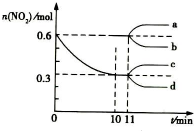 汽车尾气中CO、NO2在一定条件下可发生反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200KJ/mol,一定温度下,向容积固定为 2L的密闭容器中充入一定量的 CO和 NO2,NO2 的物质的量随时间的变化曲线如图所示
汽车尾气中CO、NO2在一定条件下可发生反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200KJ/mol,一定温度下,向容积固定为 2L的密闭容器中充入一定量的 CO和 NO2,NO2 的物质的量随时间的变化曲线如图所示查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:填空题
研究性学习小组欲用化学方法侧量一个不规则容器的体积。把35.1gNaCl放入500mL烧杯中,加入150mL蒸馏水。待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释到完全充满容器,从中取出溶液l00mL ,该溶液怡好与20mL0.1mol/LAgNO3的溶液完全反应。
(1)求100mLNaCl溶液的物质的量浓度(写出计算过程)
(2)试计算该容器的体积_______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
在标准状况下,等质量的CH4 和CO2比较,下列说法中正确的是
A.密度比4:11 B.分子数之比为4:11
C.体积比4:11 D.物质的量之比为4:11
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
19世纪初,某科学家提出原子学说,他认为物质有原子组成,原子不能被创造,也不能被毁灭,在化学反应中不能再分,这个科学家是
A. 汤姆生 B. 道尔顿 C. 卢瑟福 D. 玻尔
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 0.1000mol•L1 HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 20.00 |
| 2 | 25.53 | 20.00 |
| 3 | 27.85 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+:1s22s22p6 | B. | F:1s22s22p5 | ||
| C. | Cl-:1s22s22p63s23p5 | D. | Mn:1s22s22p63s23p63d54s2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com