

分析 (1)根据反应生成气体的快慢分析;根据阴阳离子判断;
(2)该反应是通过反应速率分析的,所以根据v=$\frac{△c}{△t}$判断.
解答 解:(1)该反应中产生气体,所以可根据生成气泡的快慢判断;氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用;硫酸铁和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,所以将FeCl3溶液改为Fe3+浓度相同的Fe2(SO4)3溶液更为合理,
故答案为:两支试管中产生气泡的快慢;是;
(2)该反应是通过生成气体的反应速率分析判断的,所以根据v=$\frac{△c}{△t}$可知,需要测量的数据是产生40ml气体所需要的时间,
故答案为:①.
点评 本题考查了催化剂的作用及化学反应速率的影响因素等知识点,难度不大,要会分析将FeCl3改为Fe2(SO4)3更为合理的理由.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A. | 电解过程中,c电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| C. | A装置中K+移向VB2电极 | |
| D. | b装置内收集的0.448L气体(标准状况)全部为O2 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列叙述正确的是
A.12gC-13含有的原子数为NA
B.28gCO和44gCO2含有的氧原子数均为NA
C.1.7gH2O2中含有的电子数为0.9NA
D.标准状况下,2.24LH2O所含分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验目的 | 反应物 | 反应前溶液的pH | 温度 |
| I | 对照实验 | O3+H2SO4+NaI | 5 | 25℃ |
| II | ① 探究FeCl2对反应速率的影响 | O3+H2SO4+NaI+FeCl2 | 5 | ? |
| III | 探究温度对速率的影响 | O3+H2SO4+NaI | ③ 5 | 5℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
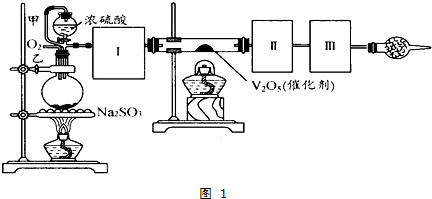
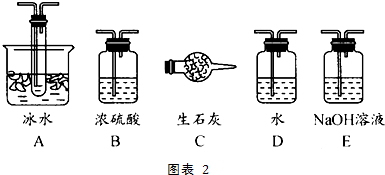
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 53 | B. | 78 | C. | 131 | D. | 184 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | K2O的电子式: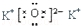 | |
| C. | 2-乙基-1,3-丁二烯分子的键线式: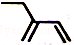 | |
| D. | 比例模型  可以表示CO2分子或SiO2 可以表示CO2分子或SiO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com