
(16分)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:

请回答下列问题:
(1)电镀污泥的主要成分是 (写化学式)。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
。
(3)析出CuCl晶体时的最佳pH在 左右。
(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是 。
(5)从滤液A中可回收的主要物质是 (写化学式)。
(6)以碳棒为电极电解CuCl2溶液可得到CuCl。写出电解CuCl2溶液后的阴极上发生的反应为
(16分)
(1)Cu(OH)2 Fe(OH)3 (每个2分,共4分)
(2)2Cu2++2Cl—+Fe=2CuCl↓+Fe2+(3分,没配平扣1分,无写“↓”不扣分)
(3)3 (2分,写“2.8~3.5”均得分)
(4)促使乙醇和水的挥发,防止CuCl被空气氧化 (2分,写对其中的一点得2分)
(5)Na2SO4和FeSO4(2分;写对其中一个得2分)
(6)Cu2++Cl-+e-===CuCl↓ (3分,无写“↓”扣1分)
解析试题分析:(1)酸性电镀废液主要含Cu2+、Fe3+,加碱后生成Cu(OH)2 Fe(OH)3,是电镀污泥的主要成分;
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl,同时还有氯化亚铁、硫酸钠生成,离子方程式为2Cu2++2Cl—+Fe=2CuCl↓+Fe2+
(3)由图可知pH=3时CuCl的产率最高,所以析出CuCl晶体时的最佳pH在3左右;
(4)真空干燥时无氧气存在,密封包装也是隔绝氧气,所以真空干燥,密封包装的目的是促使乙醇和水的挥发,防止CuCl被空气氧化;
(5)由流程图可知,氢氧化铁与氢氧化铜与酸反应后生成硫酸铜与硫酸铁,加入铁粉后,溶液中存在硫酸亚铁,氯化亚铜析出后溶液中只剩硫酸亚铁与原来加碱时生成的硫酸钠,所以从滤液A中可回收的主要物质是Na2SO4和FeSO4;
(6)电解池中阴极发生还原反应,元素化合价降低,CuCl2中Cu是+2价,CuCl中Cu是+1价,所以阴极上发生的反应是Cu2++Cl-+e-===CuCl↓。
考点:考查物质制备,工业流程的分析,电化学原理的应用


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:单选题
“天宫一号”的供电系统(RFC)是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是( )
A.当有0.1 mol电子转移时,a极产生1. 12 LH2
B.b极上发生的电极反应是:4H2O +4e-=2H2↑+4OH-
C.d极上发生的电极反应是:O2 +4H+ +4e-=2H2O
D.c极上发生还原反应,B中的H+通过隔膜进入A
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)
(1)海水中的钠盐、镁盐等都是重要的化工原料,从海水中提取铀、重水对一个国家来说具有战略意义。
①写出氯化镁的电子式__________________________
②重水的摩尔质量为____________________________
③写出金属镁的工业冶炼方程式__________________________________________
④海水淡化的常见方法有电渗析法、离子交换法、_________________
(2)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理。
①乙烯和氯化氢在一定条件下反应的化学方程式是____________________________
②决定氯乙烷能用于冷冻麻醉应急处理的具体性质是________(填选项)
| A.沸点低 | B.沸点高 | C.易挥发 | D.难挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)【化学——化学与技术】
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)多级闪蒸法是目前“海水淡化”的主要技术。该法是在一定条件下将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水。由此可判断多级闪蒸法是 (填“物理变化” 或“化学变化”)。
(2)利用海水晒盐的原理是 ;分离食盐晶体后的母液中含有KCl、MgCl2,经过分离、提纯后,可用于 。
(3)“氯碱工业”利用电解饱和食盐水制得重要化工产品。在氯碱工业中,隔膜法电解(如图甲所示)工艺逐渐被离子交换膜电解(如图乙所示)技术取代。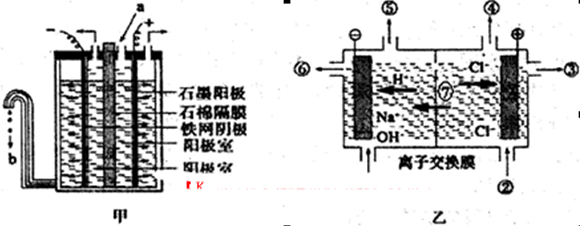
①写出两电极的反应式:阳极 ,阴极 。
②石棉隔膜的作用是 。离子交换膜电解槽中⑥、⑦分别是 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.下图为氢氧燃料电池的结构示意图,
电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1) 写出氢氧燃料电池工作时正极电极反应方程式: ___________ 。
(2)如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下___________L氧气。
(3) 若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________________。 电池总离子反应方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)氢氧燃料电池的实验装置如图所示,回答下列有关该实验的问题。
(1)要使发光二极管发亮,实验时的操作顺序是:先_______,电解一段时间后,__________;
(2)在实验的全过程中能量的主要转化形式是 ;
(3)写出下列两种操作时的电极反应式,并注明电极名称:
①按下开关S1,断开开关S2,一段时间后: C1为 极,电极反应: ;
②断开开关S1,迅速按下开关S2:(提示:此时C1附近溶液显碱性,C2附近溶液显酸性)C2为______极, 电极反应: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或 负 )。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL1.0mol/L。
(1)A为 池,(填原电池、或电解池),其中的Ag极为 极,发生 反应(填“氧化”或“还原”)。
(2)B装置中的电极b极为 极,电极反应式为 ,总反应的化学方程式为 。经过一段时间后,B装置中溶液的碱性 (填“增强”、“减弱”或“不变”)
(3)若工作一段时间后,当Zn片质量减少3.25g时,a极逸出的气体在标准状况下的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法之一是电解法。
(1)该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。用Fe作电极的原因为 。
(2)在阴极附近溶液pH升高的原因是(用电极反应解释) ,溶液中同时生成的沉淀还有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com