
【题目】通常用来衡量一个国家的石油化学工业发展水平标志的是( )
A.石油产量
B.乙烯的产量
C.合成纤维的产量
D.硫酸的产量
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图: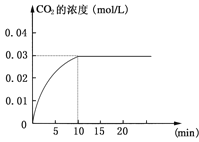
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=________ mol/L,该温度下的平衡常数K 。
(2) 判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
Ⅱ、在含有I-、Cl-的混合溶液中,逐滴加入一定量AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关。下列说法正确的是
A. 自来水中加入氯气与污水中加入明矾的原理相同
B. 汽油、甘油、花生油均能发生水解反应和氧化反应
C. 硫酸铜溶液可用于游泳池的消毒是利用了Cu2+能使蛋白质盐析
D. 现代工业生产中的芳香烃来源于石油的催化重整和煤的干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯及其化合物的说法错误的是
A.工业上电解熔融的氯化钠可以制备钠
B.工业上用Cl2和石灰乳为原料制造漂白粉
C.工业上电解饱和氯化镁溶液可制取金属镁
D.工业上常用H2在Cl2中燃烧生成的氯化氢溶于水来制取盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是( )
![]()
A. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B. 若D是一种强碱,则A、B、C均可与X反应生成D
C. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
D. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或 C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①0.01mol/LNaOH溶液的pH= 。
②100mL 0.1mol/L H2SO4溶液与100mL 0.4mol/L的KOH溶液混合后,pH= 。
(2)①已知一溶液有4种离子:X+、![]() 、H+、OH-下列分析结果肯定错误的是( )。
、H+、OH-下列分析结果肯定错误的是( )。
A.CY->CX+>CH+>COH- B.CX+>CY->COH->CH+
C.CH+>CY->CX+>COH- D.COH->CX+>CH+>CY-
②把0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液以等体积混合,则混合液中粒子浓度关系正确的是( )
A.C(CH3COO-)<C(Na+)
B.C(CH3COOH)>C(CH3COO-)
C.2C(H+)=C(CH3COO-)-C(CH3COOH)
D.C(CH3COOH)+C(CH3COO-)=0.01mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①现有11g CO2和5.5g N2O的物质的量之比为 ,摩尔质量之比为 ,氧原子的个数之比为 .
(2)质量相等的两种物质SO2和SO3,两种物质中硫元素质量之比为 ___________ ,分子物质的量之比为 ___________ ,所含氧原子个数之比为 ___________ .
(3)0.2L 0.5mol/L Al2(SO4)3溶液和0.5L 0.5mol/L Al2(SO4)3溶液所含SO42-离子浓度之比为 ___________ ,SO42-离子数目之比为 ___________ .
(4)20.6g NaR含有Na+0.2mol,则NaR的摩尔质量为 ___________ ,则含R 8.0g的NaR的物质的量为 ___________ mol.
(5)实验室用二氧化锰与浓盐酸反应制取氯气,反应方程式如下:
MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
若0.1molMnO2与足量的浓盐酸充分反应,则有 __________ mol HCl被氧化,转移电子的物质的量为 __________ mol,产生的Cl2在标准状况下的体积为 __________ L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)可逆反应2Cl2(g)+2H2O(g ![]() 4HCl(g)+O2(g) (△H>0),在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g) (△H>0),在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
①降低温度,Cl2的转化率___ _______;υ(逆)______________;
②保持容器体积不变,加入He,则HCl的物质的量__________。
③保持容器压强不变,加入He,则O2的物质的量__________;
④若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度 ____,相对分子质量_________。
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+ 6C(s) + 2N2(g)![]() Si3N4(s)+ 6CO(g)
Si3N4(s)+ 6CO(g)
①该反应的平衡常数表达式为 K= ;
②若知上述反应为吸热反应,升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);若已知CO生成速率为υ(CO)=18mol·L-1·min-1,则N2消耗速率为υ(N2)= 。
③达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如下图。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com