
【题目】(1)①现有11g CO2和5.5g N2O的物质的量之比为 ,摩尔质量之比为 ,氧原子的个数之比为 .
(2)质量相等的两种物质SO2和SO3,两种物质中硫元素质量之比为 ___________ ,分子物质的量之比为 ___________ ,所含氧原子个数之比为 ___________ .
(3)0.2L 0.5mol/L Al2(SO4)3溶液和0.5L 0.5mol/L Al2(SO4)3溶液所含SO42-离子浓度之比为 ___________ ,SO42-离子数目之比为 ___________ .
(4)20.6g NaR含有Na+0.2mol,则NaR的摩尔质量为 ___________ ,则含R 8.0g的NaR的物质的量为 ___________ mol.
(5)实验室用二氧化锰与浓盐酸反应制取氯气,反应方程式如下:
MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
若0.1molMnO2与足量的浓盐酸充分反应,则有 __________ mol HCl被氧化,转移电子的物质的量为 __________ mol,产生的Cl2在标准状况下的体积为 __________ L.
【答案】(1)2:1;1:1;4:1
(2)5:4;5:4;5:6
(3)1:1;2:5
(4)103g/mol;0.1
(5)0.2;0.2;2.24.
【解析】
试题分析:(1)11g CO2和5.5g N2O的物质的量之比为:![]() ;摩尔质量之比等于相对分子质量之比,为1:1;氧原子的个数之比等于氧原子的物质的量之比,等于
;摩尔质量之比等于相对分子质量之比,为1:1;氧原子的个数之比等于氧原子的物质的量之比,等于![]() ;(2)质量相等的两种物质SO2和SO3,两种物质中硫元素质量之比为
;(2)质量相等的两种物质SO2和SO3,两种物质中硫元素质量之比为![]() ;根据公式
;根据公式![]() 可知,质量相等时,物质的量与摩尔质量成反比,因此分子的物质的量之比为80:64=5:4;所含氧原子的个数之比等于氧原子的物质的量之比,为:
可知,质量相等时,物质的量与摩尔质量成反比,因此分子的物质的量之比为80:64=5:4;所含氧原子的个数之比等于氧原子的物质的量之比,为:![]() ;(3)0.2L 0.5mol/L Al2(SO4)3溶液中SO42-离子浓度为
;(3)0.2L 0.5mol/L Al2(SO4)3溶液中SO42-离子浓度为![]() ,0.5mol/L,0.5L 0.5mol/L Al2(SO4)3溶液所含SO42-离子浓度为
,0.5mol/L,0.5L 0.5mol/L Al2(SO4)3溶液所含SO42-离子浓度为![]() ,故SO42-离子浓度之比为1:1,由此可见,物质的量浓度与溶液的体积无关。SO42-离子数目之比为
,故SO42-离子浓度之比为1:1,由此可见,物质的量浓度与溶液的体积无关。SO42-离子数目之比为![]() ,由此可见,离子的数目与溶液的体积有关。(4)20.6g NaR含有Na+0.2mol,则NaR的物质的量为0.2mol,则其摩尔质量为:
,由此可见,离子的数目与溶液的体积有关。(4)20.6g NaR含有Na+0.2mol,则NaR的物质的量为0.2mol,则其摩尔质量为:![]() ;R元素的相对原子质量为:
;R元素的相对原子质量为:![]() ;则含R 8.0g的NaR的物质的量为
;则含R 8.0g的NaR的物质的量为![]() ;(5)根据氧化还原方程式可知,若0.1molMnO2与足量的浓盐酸充分反应,则0.2molHCl被氧化,生成0.1mol Cl2,转移0.2mole-,因此产生的Cl2在标准状况下的体积为:
;(5)根据氧化还原方程式可知,若0.1molMnO2与足量的浓盐酸充分反应,则0.2molHCl被氧化,生成0.1mol Cl2,转移0.2mole-,因此产生的Cl2在标准状况下的体积为:![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2(g) + O2(g) == 2H2O(1) △H= ―285.8kJ/mol
B.2H2(g) + O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C.2H2(g) + O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D.H2(g) + ![]() O2(g) == H2O(1) △H= ―285.8kJ/mol
O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式是_______________.
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,反应的离子方程式是_______________.
(3)对比(1)和(2)实验所得的结果,将Cl-、I-、SO2按还原性由强到弱顺序排列为_______________.
(4)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O.
①当有0.2mole-转移时被氧化的HCl的质量是_______________;
②如果将20mL12molL-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将_______________.
A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,该化合物有漂白性,能使品红溶液褪色,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)Z原子的价电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 。
(3)X与M形成的XM3分子的空间构型是 ,中心原子的杂化轨道类型 为 。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如下图所示,则图中黑球代表的离是____________(填离子符号)。
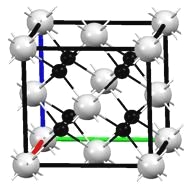
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:

下列说法不正确的是( )
A.反应Ⅱ、III和Ⅳ的氧化剂一定相同
B.甲、乙、丙三种物质中都含有氮元素
C.反应Ⅵ的部分产物可在上述流程中循环利用
D.反应V的化学方程式为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色能源是指使用过程中不排放或排放极少的污染物的能源,下列能源中不属于绿色能源的是( )
A. 太阳能 B. 化石能源 C. 风能 D. 潮汐能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊、庚是由其中的两种、三种或四种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体,丁为强碱。已知反应:①甲+乙→丁+己,②庚→乙+丙+戊。
完成下列问题:
(1)元素X在周期表中的位置为______________。
(2)元素Y、Z的简单离子的半径大小顺序为r(___________)>r(__________)。(填化学符号)
(3)化合物甲中的阴阳离子的个数比为______________。
(4)质量为a g的甲与足量的乙完全反应转移的电子数为__________。(用NA表示阿伏加德罗常数的值)
(5)写出反应“丁+庚→乙+戊”的离子方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
(1)在密闭容器中充入NH3和CO2 ,一定条件能自发进行的原因是__________________
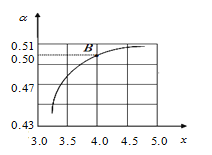
(2)T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是 ;
=x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是 ;
(3)当x=2,上述反应至5min时各物质的浓不再发生变化,若起始的压强为P0 KPa,测得平衡体系压强变为起始时的![]() 。反应结束后,分离得到90g尿素。
。反应结束后,分离得到90g尿素。
试计算该反应的平均速率v(CO2)= ,
该反应的平衡常数(K)=____ _,
达到平衡后NH3的物质的量浓度为 ,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com