
【题目】Ⅰ在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图: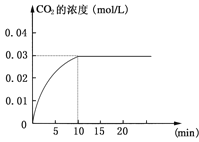
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=________ mol/L,该温度下的平衡常数K 。
(2) 判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
Ⅱ、在含有I-、Cl-的混合溶液中,逐滴加入一定量AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
【答案】Ⅰ、(1)0.003;0.03;9(2)①③(3)0.01Ⅱ、4.7×10-7
【解析】
试题分析:Ⅰ、(1)v(CO2)=(0.03mol/L0)÷10min=0.003mol/(L·min),根据同一反应中同一时间段内各物质的反应速率之比等于其计量数之比得v(CO)=v(CO2)=0.003mol/(L·min);平衡时CO2的浓度是0.03mol/L,则根据方程式可知生成氢气的浓度是0.03mol/L;
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始(mol/L) 0.04 0.04 0 0
反应(mol/L) 0.03 0.03 0.03 0.03
平衡(mol/L) 0.01 0.01 0.03 0.03
因此该反应化学平衡常数K=c(CO2)·c(H2)/c(CO)·c(H2O)=(0.03×0.03)/(0.01×0.01)=9;
(2)①CO减少的化学反应速率和CO2减少的化学反应速率相等表示正逆反应速率相等,反应达到平衡状态,正确;②CO、H2O、CO2、H2的浓度都相等,该反应不一定达到平衡状态,与反应初始浓度及转化率有关,错误;③CO、H2O、CO2、H2的浓度都不再发生变化,正逆反应速率相等,该反应达到平衡状态,正确;④平衡时正、逆反应速率相等,但不为零,错误,答案选①③;
(3)设平衡时c(CO)为xmol/L,
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始(mol/L) 0.02 0.02 0.02 0.02
反应(mol/L) 0.02-x 0.02-x 0.02-x 0.02-x
平衡(mol/L) x x 0.04-x 0.04-x
温度不变,化学平衡常数不变,所以化学平衡常数K=(0.04x)·(0.04x)/x·x=9,解得x=0.01;
Ⅱ、当AgCl开始沉淀时,溶液中![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】民以食为天,食品安全越来越受到大家的关注。下列有关说法正确的是( )
A. 二氧化硫有毒,严禁将其添加到任何食品和饮料中
B. 饮食“镉大米”会影响骨骼和肾脏,镉元素属于重金属元素
C. 使用增塑剂——邻苯二甲酸酯可使聚氯乙烯由弹性塑胶变为硬塑胶
D. 面粉生产中禁止添加的过氧化钙(CaO2)中阴阳离子的个数比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】 (15 分)
钒、砷均属于第四周期元素,最高正价均为+5。
I .高纯度砷可用于生产具有“半导体贵族”之称的新型半导体材料GaAs,砷与氯气反应可得到 AsCl3、AsCl5两种氯化物。
(1)AsCl3分子的空间构型是 ,中心原子杂化类型是 。两种氯化物分子中属于非极性分子的是 。
(2)Ga与As相比,第一电离能较小的元素是 ,GaAs中砷的化合价为 。
II.钒是一种重要的战略金属,其最主要的用途是生产特种钢,其化合价有+5、+4、+3、+2等,工业上从炼钢获得的富钒炉渣中(内含 V2O5)提取钒的过程如下。
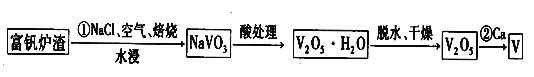
(3)基态钒原子的价电子排布式为 ,写出反应①的化学方程式: 。
(4)已知单质钒的晶胞为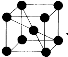 ,则 V 原子的配位数是 ,假设晶胞的边长为 a cm, 密度为 ρ g/cm3,则钒的相对原子质量为 。
,则 V 原子的配位数是 ,假设晶胞的边长为 a cm, 密度为 ρ g/cm3,则钒的相对原子质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 不含其他杂质的天然油脂属于纯净物 B. 油脂在酸性条件下水解称为皂化
C. 油脂的烃基部分饱和程度越大,熔点越低 D. 各种油脂水解后的产物中都有甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 煤、石油和某些金属矿物燃烧或冶炼时,往往会产生二氧化硫,引起酸雨
B. 推广使用煤的液化技术,从根本上减少二氧化碳等温室气体的排放
C. 使用光导纤维长距离输送电流,可以降低电能损耗
D. 明矾可作净水剂,常用于水体杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项内容中,属于化学科学研究内容的是
A. 利用指南针确定航海方向
B. 培育新品种,增加农作物产量
C. 综合利用石油,合成优良人造纤维
D. 设计新程序,开发电脑新功能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2(g) + O2(g) == 2H2O(1) △H= ―285.8kJ/mol
B.2H2(g) + O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C.2H2(g) + O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D.H2(g) + ![]() O2(g) == H2O(1) △H= ―285.8kJ/mol
O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com