
【题目】在一定体积的密闭容器中进行化学反应CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示

请回答下列问题:
(1)该反应的正反应为______(填“吸热”或“放热”)反应,
(2)某温度下,在2L的密闭容器中,加入 1molCO2和 1mol H2,充分反应达平衡时,CO的平衡浓度为0.25mol/L,试判断此时的反应温度为________
(3)若在(2)所处的温度下,在1L的密闭容器中,加入2moCO2和3 mol H2,则充分反应达平衡时,H2的物质的量______
A.等于1.0mol B.大于1.0mol
C.大于0.5mol,小于1.0mol D.无法确定
【答案】吸热 830 B
【解析】
(1)由表中数据可知,温度越高平衡常数越大,说明升高温度平衡向正反应移动,温度升高平衡向吸热反应移动;
(2)计算平衡时各物质的量的浓度,再根据k=c(CO)·c(H2O)/c(CO2)·c(H2)计算平衡常数判断温度;
(3)令平衡时参加反应的CO2的物质的量为ymol,则:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
开始(mol):2 3 0 0
变化(mol):y y y y
平衡(mol):2-y 3-y y y
再根据平衡常数k=c(CO)·c(H2O)/c(CO2)·c(H2)=1列方程计算解答.
(1)由表中数据可知,温度越高化学平衡常数越大,升高温度平衡向正反应移动,温度升高平衡向吸热反应移动,故该反应正反应是吸热反应;
(4)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol·L-1,则:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始浓度(mol):0.5 0.5 0 0
变化浓度(mol):0.25 0.25 0.25 0.25
平衡浓度(mol):0.25 0.25 0.25 0.25
平衡常数K=![]() =1,
=1,
故所处温度为830℃;
令平衡时参加反应的CO2的物质的量为ymol,则:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
开始(mol):2 3 0 0
变化(mol):y y y y
平衡(mol):2-y 3-y y y
再根据平衡常数k=c(CO)·c(H2O)/c(CO2)·c(H2)=1
则平衡常数K=![]() =1,解得y=1.2,故平衡时H2的物质的量为3mol-1.2mol=1.8mol。
=1,解得y=1.2,故平衡时H2的物质的量为3mol-1.2mol=1.8mol。
故选B。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关化合物X、Y的说法不正确的是( )
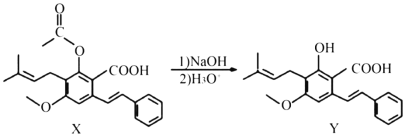
A.1 mol X最多能与2 mol NaOH反应
B.Y与乙酸发生酯化反应可得到X
C.X、Y均能与酸性KMnO4溶液反应
D.室温下,X、Y分别与足量Br2加成的产物分子中的手性碳原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是重要的化工原料,用途非常广泛。
实验一:SO2可以抑制细菌滋生,具有防腐功效。某实验小组欲用下图所示装置测定某品牌葡萄酒中(葡萄酒中含有乙醇、有机酸等)的SO2含量。
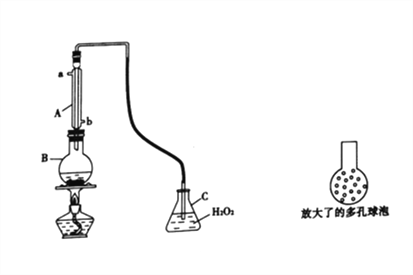
(1)仪器A的名称是________;使用该装置主要目的是____________________。
(2)B中加入 300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,C中化学方程式为_________________________________________。
(3)将输入C装置中的导管顶端改成具有多孔的球泡(如图15所示)。可提高实验的准确度,理由是_______________________________________。
(4)除去C中的H2O 然后用0.099mol·L-1NaOH标准溶液滴定。
①用碱式滴定管量取0.09mol·L-1NaOH标准溶液前的一步操作是___________________________;
②用该方法测定葡萄酒中SO2的含量偏高,主要原因是__________________________________,利用现有的装置,提出改进的措施是_______________________________________________。
(5)利用C中的溶液,有很多实验方案测定葡萄酒中SO2的含量。现有0.1mol·L-1BaCl2溶液,实验器材不限,简述实验步骤:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个6L的密闭容器中,放入3LX(g)和2LY(g),在一定条件下发生下列反应:4X(g)+3Y(g)2Q(g)+nR(g)达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n的值是
A.3B.4C.5D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C![]() CO2↑+2H2O+2SO2↑。用如图所示装置设计一个实验,验证浓硫酸与木炭粉在加热条件下反应产生的各种产物。
CO2↑+2H2O+2SO2↑。用如图所示装置设计一个实验,验证浓硫酸与木炭粉在加热条件下反应产生的各种产物。
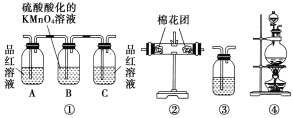
(1)这些装置的连接顺序(按产物气流从左到右的方向)是____→___→____→____。(填装置的序号)
(2)装置②中要检验产物中有水蒸气,则放入的药品是______;装置③中要检验产物中有二氧化碳气体,则放入的药品是___________;实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是_______,B瓶溶液的作用是_________,C瓶溶液的作用是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,40 g、10%硝酸钠溶液与60 g、7.5%的硝酸钠溶液混合,得到密度为1.20 g·cm-3的混合溶液,计算:
(1)该混合溶液中溶质的质量分数为__;
(2)该混合溶液中NaNO3的物质的量浓度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥法标出下列反应电子转移的方向和数目。
(1)4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O_________________
MnCl2+Cl2↑+2H2O_________________
(2)2KClO3![]() 2KCl+3O2↑__________
2KCl+3O2↑__________
(3)Cl2+2NaOH===NaClO+NaCl+H2O__________
(4)2H2O2![]() 2H2O+O2↑__________
2H2O+O2↑__________
(5)S+2H2SO4(浓)![]() 3SO2↑+2H2O__________
3SO2↑+2H2O__________
(6)6HCl+KClO3===3Cl2↑+KCl+3H2O__________
(7)3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O__________
(8)2KMnO4![]() K2MnO4+MnO2+O2↑__________
K2MnO4+MnO2+O2↑__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中氢离子浓度为0.1 mol·L-1。下列叙述不正确的是( )
A.反应中共消耗1.8 mol 硫酸B.气体甲中二氧化硫与氢气的体积比为4∶1
C.反应中共消耗97.5 g 锌D.反应中共转移3 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在大试管内将足量NaHCO3加热到 200℃,将产生的混合气体通入到盛有1.87 g Na2O和Na2O2的密闭容器中,待Na2O和Na2O2全部反应后,得到标准状况下224 mL O2;再将反应后密闭容器内的固体全部溶于水配成 100 mL 溶液。下列说法正确的是
A.Na2O和Na2O2 均为碱性氧化物
B.参加反应的NaHCO3物质的量为 0.04 mol
C.反应过程中总共转移 0.04 mol 电子
D.配成的 100 mL 溶液中 c(Na+) = 0.5 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com