
【题目】用双线桥法标出下列反应电子转移的方向和数目。
(1)4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O_________________
MnCl2+Cl2↑+2H2O_________________
(2)2KClO3![]() 2KCl+3O2↑__________
2KCl+3O2↑__________
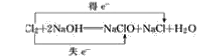
(3)Cl2+2NaOH===NaClO+NaCl+H2O__________
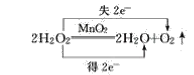
(4)2H2O2![]() 2H2O+O2↑__________
2H2O+O2↑__________
(5)S+2H2SO4(浓)![]() 3SO2↑+2H2O__________
3SO2↑+2H2O__________
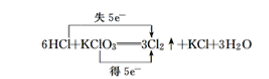
(6)6HCl+KClO3===3Cl2↑+KCl+3H2O__________
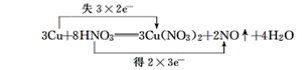
(7)3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O__________
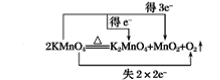
(8)2KMnO4![]() K2MnO4+MnO2+O2↑__________
K2MnO4+MnO2+O2↑__________
【答案】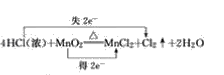


【解析】
计算、对比方程式中变价元素化合价的升降,确定元素化合价变化;结合在氧化还原反应中,若元素的化合价升高,则失去电子,发生氧化反应(被氧化);若元素的化合价降低,则得到电子,发生还原反应(被还原)。确定元素得电子还是失电子;然后计算得失电子的个数:得失电子的数目=化合价的变化值×化合物中变价元素原子个数×该化合物的化学计量数。
(1)反应中Mn的化合价由+4变为+2价,部分Cl的化合价由-1变为0价,则最小公倍数为2,则双线桥法为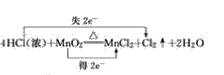 ;
;
(2) 反应中Cl的化合价由+5变为-1价,部分O的化合价由-2变为0价,则最小公倍数为12,则双线桥法为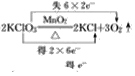 ;
;
(3)反应中部分Cl的化合价由0变为+1价,部分Cl的化合价由0变为-1价,则最小公倍数为1,则双线桥法为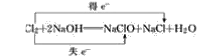 ;
;
(4)反应中部分O的化合价由-1变为-2价,部分O的化合价由-1变为0价,则最小公倍数为2,则双线桥法为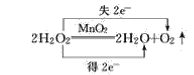 ;
;
(5) 反应硫酸中S的化合价由+6变为+4价,S的化合价由0变为+4价,则最小公倍数为4,则双线桥法为 ;
;
(6) 反应氯酸钾中Cl的化合价由+5变为0价,HCl中Cl的化合价由-1变为0价,则最小公倍数为5,则双线桥法为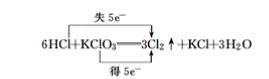 ;
;
(7) 反应中Cu的化合价由0变为+2价,N的化合价由+5变为+2价,则最小公倍数为6,则双线桥法为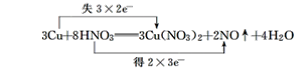 ;
;
(8) 反应中Mn的化合价由+7变为+4、+6价,O的化合价由-2变为0价,则最小公倍数为4,则双线桥法为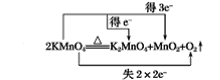 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是氮循环的一部分:

(1)通常状况下,NO2的颜色是__________;
(2)反应①的化学方程式是________________________________;
(3)NO2易溶于水,并和水发生化学反应。该反应中,氧化剂是_________;
(4)化合物A的化学式是_______________;
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:
2NO + 2CO = 2CO2 + N2。当生成2mol N2时,被还原的NO为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中进行化学反应CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示

请回答下列问题:
(1)该反应的正反应为______(填“吸热”或“放热”)反应,
(2)某温度下,在2L的密闭容器中,加入 1molCO2和 1mol H2,充分反应达平衡时,CO的平衡浓度为0.25mol/L,试判断此时的反应温度为________
(3)若在(2)所处的温度下,在1L的密闭容器中,加入2moCO2和3 mol H2,则充分反应达平衡时,H2的物质的量______
A.等于1.0mol B.大于1.0mol
C.大于0.5mol,小于1.0mol D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醇是一种重要的化工原料,广泛用于香料、造纸、制药和印染等行业。实验室制备苯甲醇的反应原理和有关数据如图:
2 +K2CO3+H2O→2
+K2CO3+H2O→2 +CO2↑+2KCl
+CO2↑+2KCl

实验步骤:如图所示,在装有电动搅拌器的250mL三颈烧瓶里加入9.0g碳酸钾(过量),70.0mL水,加热溶解,再加入2.0mL四乙基溴化铵[(CH3CH2)4NBr]溶液和10.0mL氯化苄。搅拌加热回流反应1~1.5h。反应结束后冷却,并转入125mL分液漏斗中,分出有机层,水层用萃取剂萃取三次。合并萃取液和有机层,加入无水硫酸镁固体,静置、过滤。最后进行蒸馏纯化,收集200~208℃的馏分,得8.4mL苯甲醇。

回答下列问题:
(1)仪器X的名称是_________,冷却水应从_________(填“上口”或“下口”)通入。
(2)本实验中加入无水硫酸镁的目的是_________。从绿色化学角度考虑,萃取剂宜采用___(填字母)。
A.乙醇 B.乙酸乙酯 C.苯 D.氯仿
(3)某同学认为该装置中的电动搅拌器可以换成沸石,以防暴沸。该说法______(填“是”或“否”)正确,其理由是_______________。
(4)四乙基溴化铵没有直接参与反应,但大大提高了反应速率,其原因可能是____________。
(5)本实验苯甲醇的产率为______%(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应式:mX(g)+nY(?)![]() pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的
pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的![]() ,c(X)=0.5mol/L,下列说法正确的是( )
,c(X)=0.5mol/L,下列说法正确的是( )
A.反应向逆方向移动B.Y可能是固体或液体
C.系数n>mD.Z的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将几滴KSCN(SCN-是“类似卤离子”)溶液加入到酸性的含有Fe3+的溶液中,溶液变为红色,将该红色溶液分为两份:①向其中—份溶液中加入适量KMnO4溶液,红色褪去;②向另一份溶液中通入SO2,红色也褪去。下列说法中不正确的是
A. ①中红色褪去的原因是KMnO4将SCN-氧化,使Fe(SCN)3消失
B. ②中红色褪色的原因是SO2将Fe3+还原为Fe2+
C. ②中红色裡色的原因是SO2将SCN-还原
D. SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中两溶液间的反应,不能用同一离子方程式来表示的是( )
A.Na2CO3+HCl;K2CO3+HNO3
B.Fe+HCl;Fe+H2SO4
C.BaCl2+Na2SO4;Ba(OH)2+H2SO4
D.NaOH+H2SO4;Ba(OH)2+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的绿色能源,![]() 是一种温室气体,都是重要的化工原料。
是一种温室气体,都是重要的化工原料。
(1)已知CO(g)+2H2(g)![]() CH3OH(1);ΔH=-129kJ·mol1,该反应的ΔS_________(填“>”或“<”)0。
CH3OH(1);ΔH=-129kJ·mol1,该反应的ΔS_________(填“>”或“<”)0。
(2)向温度不同容积均为1L的a、b、c、d、e五个恒容密闭容器中各充入3molCO2、7molH2的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=QkJ·mol1,反应过程中维持各容器温度不变,测得t1时刻各容器中H2O的体积分数(H2O)如图所示。
CH3OH(g)+H2O(g)ΔH=QkJ·mol1,反应过程中维持各容器温度不变,测得t1时刻各容器中H2O的体积分数(H2O)如图所示。

①Q_______(填“>”或“<”)0,五个容器中肯定处于非平衡状态的是_________。
②t1时刻时,容器a中正反应速率________(填“大于”“小于”或“等于”)容器e中正反应速率;
③Td℃时,该反应的平衡常数K=__________;
④欲提高H2的转化率,可采取的措施有______________________,(写出两种);
(3)碳捕捉技术的应用既可降低碳排放也可得到重要的化工产品.
①请写出CO2的电子式_______________________________。
②NaOH溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(NaHCO3)∶c(Na2CO3)=1∶1,则所得溶液的离子浓度的大小关系是____________。
③在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3,将微溶的CaSO4难溶性的CaCO3的理由是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com