
【题目】某盐的组成可表示为3[H3ON5]·3[NH4N5]·NH4Cl。回答下列问题:
(1)氯原子的电子排布式为________________。
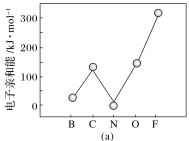
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_________________;氮元素的E1呈现异常的原因是__________________。
(3)经X射线衍射测得化合物3[H3ON5]·3[NH4N5]·NH4Cl的晶体结构,其局部结构如图(b)所示。
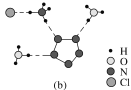
①H3O+中心原子的杂化类型为________,NH4+的空间构型为________。
②3[H3ON5]·3[NH4N5]·NH4Cl中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π![]() ),则N5-中的大π键应表示为________。
),则N5-中的大π键应表示为________。
③图(b)中虚线代表氢键,其中表示式为(NH4+)N—H…Cl、________、________。
【答案】1s22s22p63s23p5 同周期元素随核电荷数增大,原子半径逐渐变小,故结合一个电子释放出的能量(E1)依次增大 N原子的2p轨道为半充满状态,具有稳定性,故不易结合一个电子 sp3杂化 正四面体 5 Π (H3O+)O—H…N(N![]() ) (NH
) (NH![]() )N—H…N(N
)N—H…N(N![]() )
)
【解析】
(1)、氯原子的核电荷数为17,其电子排布式为1s22s22p63s23p5;
(2)、周期元素随核电荷数依次增大,原子半径逐渐变小,故结合1个电子释放出的能量依次增大,氮原子的2p轨道为半充满状态,具有稳定性;
故答案为:同周期元素随核电荷数增大,原子半径逐渐变小,故结合一个电子释放出的能量(E1)依次增大;N原子的2p轨道为半充满状态,具有稳定性,故不易结合一个电子;
(3)①H3O+中价层电子对数都是3且含有一对孤电子对,所以为三角锥形结构,中心原子的杂化类型为sp3杂化,NH![]() 中价层电子对个数是4且不含孤电子对,其空间构型为正四面体;
中价层电子对个数是4且不含孤电子对,其空间构型为正四面体;
②3[H3ON5]·3[NH4N5]·NH4Cl中阴离子N![]() 中的σ键总数为5个,根据已知信息,N
中的σ键总数为5个,根据已知信息,N![]() 中参与形成大π键的原子数为5,形成大π键的电子数为6,所以N
中参与形成大π键的原子数为5,形成大π键的电子数为6,所以N![]() 中的大π键表示为Π;
中的大π键表示为Π;
③图(b)中虚线代表氢键,其中表示式为(NH![]() )N—H…Cl、(H3O+)O—H…N(N
)N—H…Cl、(H3O+)O—H…N(N![]() )、(NH
)、(NH![]() )N—H…N(N
)N—H…N(N![]() );
);
故答案为:sp3杂化;正四面体;5 ;Π;(H3O+)O—H…N(N![]() );(NH
);(NH![]() )N—H…N(N
)N—H…N(N![]() )。
)。


科目:高中化学 来源: 题型:
【题目】镍铬钢俗称不锈钢,在日常生活中应用广泛,含有铁、铬、镍、碳等元素。
请回答下列问题:
(1)镍的基态原子核外价层电子排布式为_______________,基态Fe3+有_____种不同运动状态的电子,基态铬原子有__________个未成对电子。
(2)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_______________(填元素符号),铬的高价化合物可将CH3CH2OH 氧化为CH3CHO,CH3CHO 中—CH3和—CHO 中碳原子的杂化方式分别为_______________、___________________。
(3)镍能与CO 形成Ni(CO)4,常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是__________晶体,组成Ni(CO)4的三种元素电负性由大到小的顺序为_______________(填元素符号),CO 分子中π键与σ键的个数比为_______________。
(4)NiO 的立方晶体结构如图所示,则O2-填入Ni2+构成的________空隙(填“正四面体”、“正八面体”、“ 立方体”或“压扁八面体”)。NiO晶体的密度为ρg·cm-3,Ni2+和O2-的半径分别为r1pm和r2pm,阿伏加德罗常数值为NA,则该晶胞中原子的体积占晶胞体积的百分率为___________________________________。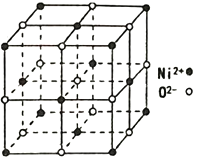
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题。
(1)氮、磷、砷的电负性的大小关系是 ,砷原子M层电子排布式为 。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为 ,该化学键能够形成的原因是 。
(3)已知:
CH4 | SiH4 | NH3 | PH3 | |
沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
分解温度(K) | 873 | 773 | 1073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,沸点高低的原因是 。
② NH3和PH3比较,分解温度高低的原因是 。
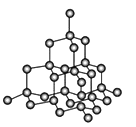
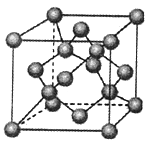
(4)金刚石是原子晶体,含有的最小环是六元环(如右边图),每个碳原子连接 个六元环,如左边图是金刚石的晶胞,若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,碳原子在晶胞中的空间占有率 (不要求计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下问题:
(1)C、N、O三种元素的第一电离能由大到小的顺序是__________________。
(2)C、Si、N的电负性由大到小的顺序是__________________。
(3)氟化氢水溶液中存在的氢键有_________种。
(4)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,Ni的基态原子有________种能量不同的电子。很多不饱和有机物在Ni催化下可以H2发生加成反应。如①CH2=CH2、②HC≡CH、③![]() 、④HCHO,其中碳原子采取sp2杂化的分子有__________(填物质编号),HCHO分子的立体构型为______________。
、④HCHO,其中碳原子采取sp2杂化的分子有__________(填物质编号),HCHO分子的立体构型为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用pH传感器探究NaOH溶液与硫酸、硫酸铜混合溶液发生反应的离子反应顺序,绘得三份曲线图如图。已知实验使用的NaOH溶液浓度和滴速相同;硫酸溶液和硫酸铜溶液浓度相同;混合溶液中两溶质的浓度也相同。
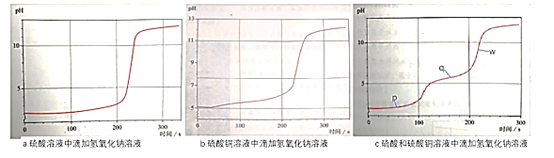
以下解读错误的是
A.三个时点的c(Cu2+):p>q>w
B.w点:c(Na+)>c(SO42-)>c(Cu2+)>c(H+)
C.混合溶液中滴加NaOH溶液,硫酸先于硫酸铜发生反应
D.q点时溶液离子浓度:c(SO42-)+c(OH-)=c(Cu2+)+c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物广泛应用于生活、生产、国防等领域。
(1)已知:元素的一个基态的气态原子得到一个电子形成-1价气态阴离子时所放出的能量称为该元素的第一电子亲和能,用E1表示。从-1价的气态阴离子再得到1个电子,成为-2价的气态阴离子所放出的能量称为第二电子亲和能E2,依此类推。FeO是离子晶体,其晶格能可通过如下的Born-Haber循环计算得到。
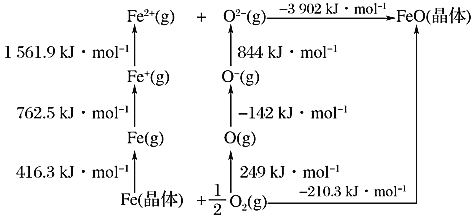
铁单质的原子化热为__________kJ/mol,FeO的晶格能为__________kJ/mol,基态O原子E1____________E2(填“大于”或“小于”),从原子结构角度解释_________。
(2)乙二胺四乙酸又叫做EDTA(图1),是化学中一种良好的配合剂,形成的配合物叫做螯合物。EDTA在配位滴定中经常用到,一般是测定金属离子的含量。已知:EDTA配离子结构(图2)。
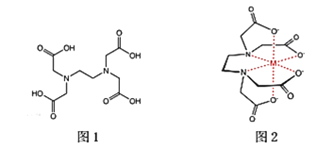
EDTA中碳原子轨道的杂化类型为____________,EDTANa-Fe(Ⅲ)是一种螯合物,六个配位原子在空间构型为____________。EDTANa-Fe(Ⅲ)的化学键除了σ键和配位键外,还存在____________。
(3)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O 围成的正四面体空隙和如3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,O2-数与正四面体空隙数(包括被填充的)之比为__________,有__________%的正八面体空隙填充阳离子。Fe3O4晶胞的八分之一是图示结构单元(图3),晶体密度为5.18 g/cm3,则该晶胞参数a=____________pm。(写出计算表达式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1L0.3mol L1HA溶液与0.1molNaOH固体混合,使之充分反应得到溶液(a)。然后向该溶液中通入HCl或加入NaOH固体(忽略体积和温度变化),溶液pH随通(加)入物质的量的变化如图。下列叙述错误的是

A. HA是一种弱酸
B. 向a点对应溶液中通入HCl,充分反应后,c(H+)/c(HA)增大
C. b点对应溶液中:c(Na+)=c(Cl-)>c(HA)>c(H+)>c(OH-)
D. c点对应溶液中:c(Na+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如图所示,其中B、D、E的结构中均含有2个—CH3,它们的核磁共振氢谱中均出现4个峰。请回答:
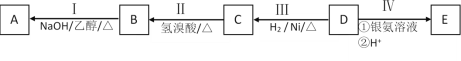
(1)A中所含官能团的名称为___;
(2)Ⅰ的反应类型为___(填字母序号),Ⅲ的反应类型为___;
a.取代反应 b.加成反应 c.氧化反应 d.消去反应
(3)D的分子式为___;
(4)写出下列反应的化学方程式:
Ⅰ:___;
Ⅱ:___;
III:C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为___;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个—CH3,写出其顺式结构的结构简式___;
(6)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:

已知以下信息:
①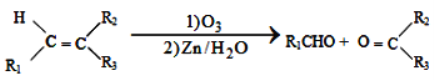
②1molB经上述反应可生成2molC,且C不能发生银镜反应。
③D属于单取代芳香烃,其相对分子质量为106。
④核磁共振氢谱显示F苯环上有两种化学环境的氢。
⑤
回答下列问题:
(1)由A生成B的化学方程式为_______________________。
(2)D的化学名称是______________________。
(3)G的结构简式为_______________________。
(4)F的同分异构体中含有苯环的还有____种(不考虑立体异构)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
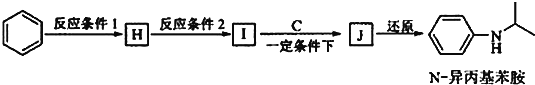
反应条件2所选用的试剂是_____________________, I的结构简式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com