
【题目】有下列一系列反应,最终产物为草酸(乙二酸)。
A![]() B
B![]() C
C![]() D
D![]() E
E![]()
![]()
已知A为某一溴代物。
请回答下列问题:
(1)推测下列化合物的结构简式:
B________________________,E________________________。
(2)D 分子中的官能团名称是_______________________。
(3)写出下列转化过程的化学方程式:
A→B________________________;反应类型:_______________________。
【答案】 CH2=CH2 OHC-CHO 羟基 CH3CH2Br+NaOH—→CH2=CH2↑+NaBr+H2O 消去反应
【解析】E被氧化生成乙二酸,则E是乙二醛,其结构简式为:OHCCHO,D被氧化生成E,则D是乙二醇,其结构简式为:HOCH2CH2OH;A是一溴代物,A发生消去反应生成B,B和溴水发生加成反应生成C,C发生取代反应生成D,则这几种分子中碳原子个数相同,所以A是1-溴乙烷,其结构简式为:CH3CH2Br,B是CH2=CH2,C是CH2BrCH2Br。
(1)通过以上分析知,B是乙烯,其结构简式为:CH2=CH2,E是乙二醛,其结构简式为:OHCCHO,故答案为:CH2=CH2,OHCCHO;
(2)D是乙二醇,官能团为羟基,故答案为:羟基;
(3)A是1-溴乙烷,发生消去反应生成乙烯,该反应方程式为:CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O,故答案为:CH3CH2Br+NaOH
CH2=CH2+NaBr+H2O,故答案为:CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O; 消去反应。
CH2=CH2+NaBr+H2O; 消去反应。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验。
实验一 探究铜与稀硝酸反应的产物实验装置如图所示,气密性已检查。

已知:FeSO4+NO===[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显
棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是___________________________________________________________。
(2)铜片和稀硝酸反应的化学方程式为____________________________________。
(3)本实验A生成的气体中,若有NO2,则B的实验现象为__________________;
若只有NO生成,则B的实验现象是_________________。
实验二 探究化学反应产物对反应速率的影响
设计如下实验,利用上图装置测定溶液突显明显棕色的时间。
序号 | 温度 | 铜片/(g) | 硝酸/mL | 硝酸铜/g |
1 | 25 ℃ | ① | ② | ③ |
2 | 25 ℃ | 5 | 20 | 0.5 |
3 | 25 ℃ | 5 | 20 | 1.0 |
(4)请将上表中实验1的实验条件填写完整。
①________,②________,③________。
(5)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10﹣2,K2=5.4×10﹣5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题:

(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是 ,由此可知草酸晶体分解的产物中有 .装置B的主要作用是 。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验.
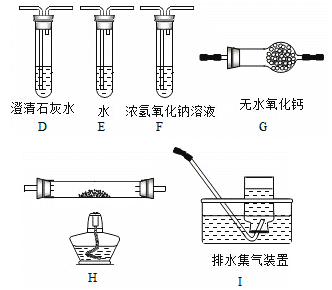
①乙组同学的实验装置中,依次连接的合理顺序为A、B、 装置H反应管中盛有的物质是 。
②能证明草酸晶体分解产物中有CO的现象是
(3)①设计实验证明:
①草酸的酸性比碳酸的强
②草酸为二元酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,
实验步骤如下:① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解 ④检漏、 转移、洗涤 ⑤ 定容、摇匀
若实验仪器有:A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
回答下列问题:
(1)需量取浓硫酸的体积为__________mL。
(2)实验时选用的仪器有(填序号) _______________,
(3)配制过程中,下列情况会使配制结果偏高的是(填序号) _______________
①定容时仰视刻度线观察液面 ②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,未再加蒸馏水补至刻度线
④.所用的浓硫酸长时间放置在密封不好的容器中⑤用量筒量取浓硫酸时仰视读数
(4)检验试剂瓶中的溶液含有SO42- 的操作是____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、常温下,将150mL 22% NaNO3溶液加100g蒸馏水后,溶液中溶质的质量分数变为14%。求原溶液的物质的量浓度________________。(小数点后保留1位)写计算过程
II、欲使100g 9.32 % 的NaOH溶液溶质的质量分数增大到20%
(1)需往溶液中加入____________克氢氧化钠?(保留小数点后2位)
(2)若20%NaOH溶液的密度为1.066 g/cm3,计算物质的量浓度__________________。(保留小数点后两位)
III.将标准状况下的HCl气体336 L溶于1.0L水中,所得盐酸密度为1.2g·cm-3,求该盐酸物质的量浓度______________________。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() ,如果要合成
,如果要合成 ![]() ,所用的原始原料可以是( )
,所用的原始原料可以是( )
A. 2 -甲基-l,3 -丁二烯和1 -丁炔 B. l,3 –戊二烯和2 -丁炔
C. 2,3 -二甲基-1,3 -戊二烯和乙炔 D. 2,3 -二甲基-l,3 -丁二烯和丙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的酸性溶液中,能大量共存的离子组是( )
A. Na+ 、K+、SO42-、HCO3 B. Cu2+、K+、SO42-、NO3
C. Na+、 K+、Cl、 NO3 D. Fe3+、K+、SO42-、Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制0.1molL﹣1的NaOH溶液,下列操作会导致所配的溶液浓度偏高的是( )
A. 用敞口容器称量NaOH且时间过长 B. 定容时俯视读取刻度
C. 原容量瓶洗净后未干燥 D. 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com