
(一)(4分)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al2O3) (2)Cl2(HCl)
(3)FeCl3(FeCl2) (4)NaHCO3溶液(Na2CO3)
(二)(6分)海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示:
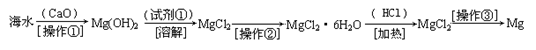
回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式 ;
操作①主要是指 ;试剂①可选用 ;
操作②是指 ;经操作③最终可得金属镁。
(三)(8分)实验室配制480ml 0.1 mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体 g。
(2)如图所示的仪器配制溶液肯定不需要的是 (填序号),本实验所需玻璃仪器E规格为 mL。
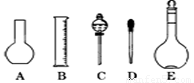
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的 。(填数字符号)
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是 。(填写字母,每种仪器只能选择一次)
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了 种用途。(填写数字)
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是 。
A.配制前没有将容量瓶中的水除尽;
B.碳酸钠失去了部分结晶水;
C.碳酸钠晶体不纯,其中混有氯化钠;
D.称量碳酸钠晶体时所用砝码生锈;
E.定容时仰视刻度线
(一)(4分)(1) NaOH溶液(2)饱和NaCl溶液(3)Cl2 (4)CO2(每格1分)
(二)(6分)CaO+H2O+MgCl2=Mg(OH)2+CaCl2(2分)过滤(1分) HCl(1分)
蒸发浓缩,冷却结晶,过滤(2分)
(三)(8分)(1)14.3;(2)AC 500 (3)①③⑤
(4)dbac (5)2 (6)CE (第(6)题2分,其它每格1分,共8分)
【解析】
试题分析:(一)(1)利用Al2O3为两性氧化物,加入NaOH溶液可除去MgO中的Al2O3杂质。
(2)Cl2在饱和NaCl溶液中的溶解度很小,所以用饱和NaCl溶液可除去Cl2中的HCl。
(3)Cl2可把FeCl2氧化为FeCl3,所以通入Cl2可除去FeCl2。
(4)CO2、H2O与Na2CO3反应生成NaHCO3,所以CO2可除去NaHCO3中的Na2CO3杂质。
(二)首先CaO与H2O反应生成Ca(OH)2:CaO+H2O=Ca(OH)2,然后Ca(OH)2与MgCl2反应生成Mg(OH)2:Ca(OH)2+MgCl2=Mg(OH)2+CaCl2,加和可得总方程式:CaO+H2O+MgCl2=Mg(OH)2+CaCl2;操作①把Mg(OH)2沉淀分离出来,为过滤;试剂①与Mg(OH)2反应生成MgCl2,为HCl;操作②是从MgCl2溶液中得到MgCl2·6H2O,为蒸发浓缩,冷却结晶,过滤。
(三)(1)配制480ml需要选用500ml容量瓶,m(Na2CO3·10H2O)=0.5L×0.1mol/L×286g/mol=14.3g。
(2)配制一定物质的量浓度的溶液,用不到烧瓶、分液漏斗;根据容量瓶的规格,本实验所用容量瓶为500ml。
(3)容量瓶上标有温度、容量和刻度线,故答案为①③⑤。
(4)首先用托盘天平称量溶质,然后把溶质放入烧杯中,加水溶解,把溶液注入容量瓶,最后用胶头滴管定容,所以在操作过程中使用的前后顺序是dbac。
(5)溶解溶质时用玻璃杯搅拌,转移溶液时用玻璃杯引流,所以玻璃棒共起到了2种用途。
(6)A、 配制前没有将容量瓶中的水除尽,对浓度无影响;B、碳酸钠失去了部分结晶水,Na2CO3变大,浓度偏高;C、碳酸钠晶体不纯,其中混有氯化钠,称量的Na2CO3变少,浓度偏低;D、称量碳酸钠晶体时所用砝码生锈,称量的Na2CO3质量变大,浓度偏高;E、定容时仰视刻度线,使溶液的体积变大,浓度偏低。
考点:本题考查物质的除杂、化学生产流程的分析、基本操作、化学方程式的书写、一定物质的量浓度的溶液的配制及误差分析。


科目:高中化学 来源: 题型:







 由甲苯与氯气在光照条件下反应生成,甲苯在工业上可通过下列流程获得:
由甲苯与氯气在光照条件下反应生成,甲苯在工业上可通过下列流程获得: 请在括号中填写加工方法或操作名称
请在括号中填写加工方法或操作名称查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省台州市路桥中学高一上学期期中考试化学试卷(带解析) 题型:实验题
(一)(4分)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al2O3) (2)Cl2(HCl)
(3)FeCl3(FeCl2) (4)NaHCO3溶液(Na2CO3)
(二)(6分)海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示:
回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式 ;
操作①主要是指 ;试剂①可选用 ;
操作②是指 ;经操作③最终可得金属镁。
(三)(8分)实验室配制480ml 0.1mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体 g。
(2)如图所示的仪器配制溶液肯定不需要的是 (填序号),本实验所需玻璃仪器E规格为 mL。
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的 。(填数字符号)
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是 。(填写字母,每种仪器只能选择一次)
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
种用途。(填写数字)
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是 。
| A.配制前没有将容量瓶中的水除尽; | B.碳酸钠失去了部分结晶水; |
| C.碳酸钠晶体不纯,其中混有氯化钠; | D.称量碳酸钠晶体时所用砝码生锈; |
查看答案和解析>>
科目:高中化学 来源:2015届浙江省台州市高一上学期期中考试化学试卷(解析版) 题型:实验题
(一)(4分)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al2O3) (2)Cl2(HCl)
(3)FeCl3(FeCl2) (4)NaHCO3溶液(Na2CO3)
(二)(6分)海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示:

回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式 ;
操作①主要是指 ;试剂①可选用 ;
操作②是指 ;经操作③最终可得金属镁。
(三)(8分)实验室配制480ml 0.1 mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体 g。
(2)如图所示的仪器配制溶液肯定不需要的是 (填序号),本实验所需玻璃仪器E规格为 mL。

(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的 。(填数字符号)
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是 。(填写字母,每种仪器只能选择一次)
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
种用途。(填写数字)
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是 。
A. 配制前没有将容量瓶中的水除尽; B. 碳酸钠失去了部分结晶水;
C. 碳酸钠晶体不纯,其中混有氯化钠; D. 称量碳酸钠晶体时所用砝码生锈;
E. 定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
(4分)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al2O3) (2)Cl2(HCl)
(3)FeCl3(FeCl2) (4)NaHCO3溶液(Na2CO3)
(二)(6分)海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示:

回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式 ;
操作①主要是指 ;试剂①可选用 ;
操作②是指 ;经操作③最终可得金属镁。
(三)(8分)实验室配制480ml 0.1 mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体 g。
(2)如图所示的仪器配制溶液肯定不需要的是 (填序号),本实验所需玻璃仪器E规格为 mL。

(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的 。(填数字符号)
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是 。(填写字母,每种仪器只能选择一次)
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
种用途。(填写数字)
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是 。
A. 配制前没有将容量瓶中的水除尽; B. 碳酸钠失去了部分结晶水;
C. 碳酸钠晶体不纯,其中混有氯化钠; D. 称量碳酸钠晶体时所用砝码生锈;
E. 定容时仰视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com