
| V |
| Vm |
| m |
| ρ |
| n |
| V |
| 224L |
| 22.4L/mol |
| 1010g |
| 1200g/L |
| 101 |
| 120 |
| 10mol | ||
|


科目:高中化学 来源: 题型:
| A、盐酸与Na2SiO3溶液混合:SiO32-+2H+═H2SiO3↓ | ||||
| B、往澄清石灰水中通入过量SO2:SO2+Ca2++2OH-═CaSO3↓+H2O | ||||
| C、NO2通入水中:H2O+3NO2═2H++2NO3-+NO | ||||
D、浓盐酸和二氧化锰共热制取Cl2:MnO2+4H++2Cl-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
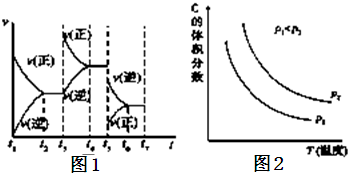
| 高温、高压 |
| 催化剂 |
| 物质 | N2 | H2 | NH3 |
| 起始(mol) | 2 | 7 | 0 |
| 10s(mol) | 1.6 | ||
| 平衡时(mol) | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
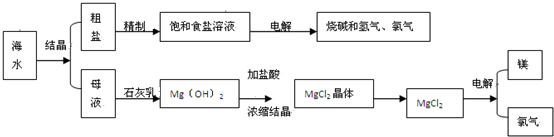
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
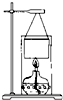 某学校化学科研小组使用一些废旧物品组装了一个简易装置,用来测定乙醇的燃烧热,过程如下:
某学校化学科研小组使用一些废旧物品组装了一个简易装置,用来测定乙醇的燃烧热,过程如下:| 1 |
| 2 |
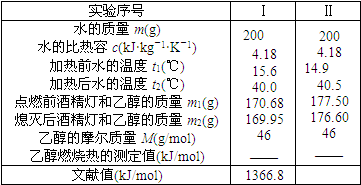
| m×c×(t2-t1)×M |
| m1-m2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com