
����Ŀ��A��B��C��D���Ƕ�����Ԫ�أ�AԪ�ص�ԭ�Ӻ������������Ӳ㣬������Ѵﵽ���ͣ�BԪ��λ��AԪ�ص���һ���ڣ������ĵ�������AԪ��������������![]() ��CԪ�ص����Ӵ���������λ����ɣ����ĺ�������Ų���AԪ��ԭ����ͬ��DԪ����CԪ����ͬһ���ڣ�DԪ��ԭ�ӵ�������������C��������������1��
��CԪ�ص����Ӵ���������λ����ɣ����ĺ�������Ų���AԪ��ԭ����ͬ��DԪ����CԪ����ͬһ���ڣ�DԪ��ԭ�ӵ�������������C��������������1��
�������������ж�
��1��A______��B______��C______��D______����Ԫ�ط��ţ���
��2��BԪ��λ�ڵ�_______����_______�壬B�����������Ļ�ѧʽ��______��������������ˮ������һ��______�ᣨ��ǿ��������
��3����C��D�ĵ����У�����ˮ��Ӧ�Ͼ��ҵķ�Ӧ�����ӷ���ʽ��______��
��4��C���ӵĺ�������Ų�ʽΪ______��Dԭ�ӵĺ�������Ų�ʽΪ______��
���𰸡�Ne Si Mg Na �� ��A SiO2 �� 2Na+2H2O=2Na++2OH-+H2�� 1s22s22p6 1s22s22p63s1
��������
A��B��C��D���Ƕ�����Ԫ�أ���AԪ�ص�ԭ�Ӻ������������Ӳ㣬������Ѵﵽ���Ϳ�֪��AΪNeԪ�أ���BԪ��λ��AԪ�ص���һ���ڣ������ĵ�������AԪ��������������![]() ��֪��BΪSiԪ�أ���CԪ�ص����Ӵ���������λ����ɣ����ĺ�������Ų���AԪ��ԭ����ͬ��֪��CΪMgԪ�أ���DԪ����CԪ����ͬһ���ڣ�DԪ��ԭ�ӵ�������������C�������������ٿ�֪��DΪNaԪ�ء�
��֪��BΪSiԪ�أ���CԪ�ص����Ӵ���������λ����ɣ����ĺ�������Ų���AԪ��ԭ����ͬ��֪��CΪMgԪ�أ���DԪ����CԪ����ͬһ���ڣ�DԪ��ԭ�ӵ�������������C�������������ٿ�֪��DΪNaԪ�ء�
��1�������Ϸ�����֪��AΪNeԪ�ء�BΪSiԪ�ء�CΪMgԪ�ء�DΪNaԪ�أ��ʴ�Ϊ��Ne��Si��Mg��Na��
��2��BԪ��ΪSiԪ�أ�λ��Ԫ�����ڱ�����������A�壻��Ԫ�ص����������Ϊ�������裬��ѧʽΪSiO2�����������Ӧ��ˮ����Ϊ���ᣬ����Ϊ���ᣬ�ʴ�Ϊ��������A��SiO2������
��3����Ԫ�صĽ�����ǿ��þԪ�أ���������ˮ��Ӧ�����������ƺ�������þ�����ˮ��Ӧ����������þ��������������ˮ��Ӧ�Ͼ��ң���Ӧ�����ӷ���ʽΪ2Na+2H2O=2Na++2OH-+H2�����ʴ�Ϊ��2Na+2H2O=2Na++2OH-+H2����
��4��þԪ�ص�ԭ������Ϊ12��þ���ӵ�����������Ϊ8�������Ų�ʽΪ1s22s22p6���Ƶ�ԭ������Ϊ11������������Ϊ1�������Ų�ʽΪ1s22s22p63s1���ʴ�Ϊ��1s22s22p6��1s22s22p63s1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��N��S�������ﳣ�����һЩ�������⣬���й����������о��ø��ֻ�ѧ������������Щ���ʶԻ����IJ���Ӱ�졣��500���ºϳɼ״��ķ�Ӧԭ��Ϊ��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)����1 L ���ܱ������У�����1 mol CO2��3 mol H2��ѹǿΪp0 �����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��(���淴Ӧ��ƽ�ⳣ��������ƽ��Ũ�ȼ��㣬Ҳ������ƽ���ѹKp����ƽ��Ũ�ȣ������ѹ=��ѹ�����ʵ�������)
CH3OH(g)��H2O(g)����1 L ���ܱ������У�����1 mol CO2��3 mol H2��ѹǿΪp0 �����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��(���淴Ӧ��ƽ�ⳣ��������ƽ��Ũ�ȼ��㣬Ҳ������ƽ���ѹKp����ƽ��Ũ�ȣ������ѹ=��ѹ�����ʵ�������)
����Ӧ���е�4 min ʱ����(��)__ (����>����<������=��)��(��)��0~4 min��H2��ƽ����Ӧ������(H2)=__ mol��L��1��min��1��
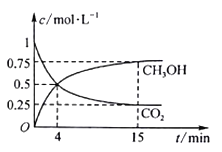
��CO2ƽ��ʱ���������Ϊ_____�����¶���KpΪ_____(�ú���p0��ʽ�ӱ�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1.0 L�����ܱ������з���0.10 mol X����һ���¶��·�����Ӧ��X(g)![]() Y(g)��Z(g) ��H��0��������������ѹǿp�淴Ӧʱ��t�ı仯��ϵ��ͼ��ʾ�����·�����ȷ���� ( )
Y(g)��Z(g) ��H��0��������������ѹǿp�淴Ӧʱ��t�ı仯��ϵ��ͼ��ʾ�����·�����ȷ���� ( )

A. ���¶��´˷�Ӧ��ƽ�ⳣ��K��3.2
B. �ӷ�Ӧ��ʼ��t1ʱ��ƽ����Ӧ����v(X)��0.2/t1 mol��L��1��min��1
C. �����ƽ����ϵ��Y�İٷֺ������ɼ���һ������X
D. �����������䣬�ٳ���0.1 mol����X��ƽ�������ƶ���X��ת���ʼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��G��ǰ������Ԫ�أ�ԭ���������������ݱ����ṩ���й���Ϣ���ش����⣺
Ԫ�� | �����Ϣ |
A | ���е������ܶ���С |
B | �γɻ�������������Ԫ�� |
D | ��̬ԭ����ֻ��3���ܼ�����2��δ�ɶԵ��� |
E | ��������ԭ�Ӱ뾶��� |
F | ���������е縺������Ԫ�� |
G | �����ֻ��һ�����ӣ��ڲ��������� |
��1��EԪ�������ڱ��е�λ����______��FԪ��ԭ�����������Ų�ʽΪ______��BD2�����幹��Ϊ______��
��2����D��E��F����Ԫ���γɵ�һ�ֳ������ʵ�ˮ��Һ�Լ��ԣ������ӷ���ʽ��ʾ���Լ��Ե�ԭ��______��
��3���⻯���ȶ��ԣ�B______D������������Ӧ��ˮ�������ԣ�C______F��(����������������)
��4��ÿ��B2A4�����к���______��������______���м���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��������ȡ�������̻������ԭ�ϣ�Ҳ����������Ĵ����ȡ�һ�ֱ����Ȼ�狀����̿���Ʊ��ߴ���̼���̵Ĺ���������ͼ��ʾ
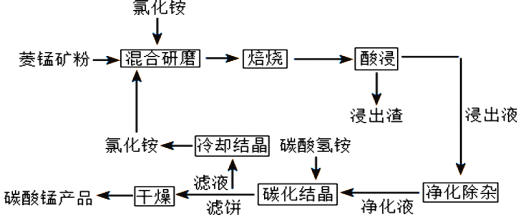
��֪�����̿�۵���Ҫ�ɷ���MnCO3������������Fe��Al��Ca��Mg��Ԫ��
�ڳ����£���ؽ���������Ũ��Ϊ0.1mol/Lʱ�γ�M(OH)n������pH��Χ���
�������� | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
��ʼ������pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
������ȫ��pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
�ش��������⣺
(1)�������ĥ��������Ϊ_______________________
(2)��������ʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ_________________________________
(3)����ͼ1��ͼ2�������Ȼ�李����̿�۵����������_____________________________
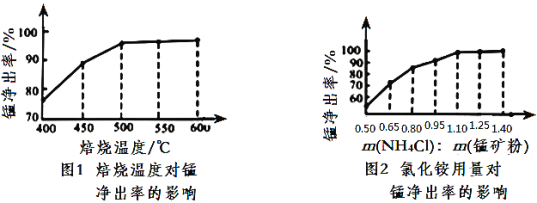
(4)����������������
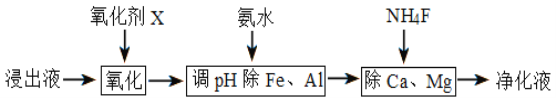
����֪������������������ǿ��˳��Ϊ(NH4)2S2O8��KMnO4��MnO2��Fe3+����������X��ѡ��__________
A��(NH4)2S2O8 B��MnO2 C��KMnO4
�ڵ���pHʱ��pH��ȡ�ķ�ΧΪ_________________
(5)��̼���ᾧ�������в�����̼��林���̼����泥����ܵ�ԭ����__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԭ�Ӻ�������Ų�ʽΪ1s22s22p3������˵����ȷ���ǣ� ��
A.��ԭ�ӵĺ�������Ų�ͼΪ![]()
B.��ԭ�Ӻ�����3��������ͬ�ĵ���
C.��ԭ�Ӻ������������3���˶�״̬��ͬ�ĵ���
D.��ԭ�Ӻ�����������ռ��3��ԭ�ӹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ����������������ٵ��ش���⡣�״���δ����Ҫ����ɫ��Դ֮һ��
(1)��֪:��25����101kPa��,1mol����ȼ������CO2��Һ̬ˮʱ����890.31kJ����д������ȼ���ȵ��Ȼ�ѧ����ʽ__________��
(2)��CO2��H2�ϳɼ״��Ļ�ѧ����ʽΪ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g).��������������������,ʵ�����¶ȶԷ�Ӧ��Ӱ������ͼ��ʾ(ע:T1��T2����300��) ��
CH3OH(g)+H2O(g).��������������������,ʵ�����¶ȶԷ�Ӧ��Ӱ������ͼ��ʾ(ע:T1��T2����300��) ��
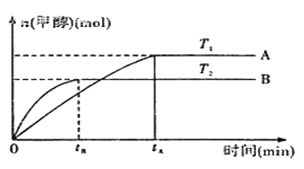
�ٺϳɼ״���Ӧ�ġ�H__________(����>������<������=��)0��
��ƽ�ⳣ���ı���ʽΪ:__________���¶�ΪT2ʱ��ƽ�ⳣ��__________(����>������<������=��)�¶�ΪT1ʱ��ƽ�ⳣ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ɡ��ͪ������������ͪ��ƻ������һ�������·�Ӧ�Ƶ�
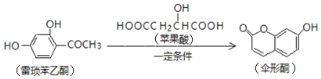
����˵������ȷ���ǣ� ��
A.һ���ӷ�Ӧ����������ͪ����3��̼̼˫��
B.ƻ�����һ�����۲�����![]()
C.1mol����ɡ��ͪ������NaOH��Һ��Ӧ����������2molNaOH
D.��Ӧ���漰���������л��ﶼ�ܸ�FeCl3��Һ������ɫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����![]()
A.![]() ����Һ��һ��������
����Һ��һ��������
B.��ȥ�Ȼ�þ��Һ�е��Ȼ������ʣ��ɼ���̼��þ����pH
C.ǿ��ζ������ѡ�÷�̪��ָʾ�����ζ��յ���������ɫͻ��Ϊ��ɫ
D.![]() ʱ��ij��Һ����ˮ���������
ʱ��ij��Һ����ˮ���������![]() ������Һ
������Һ![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com