
【题目】常温下,溶液中金属离子(Mn+)的pM[pM=-lgc(Mn+)]随溶液pH变化关系如右图所示[假定c(Mn+)≦10-6mol/L认为该金属离子沉淀完全]。下列说法不正确的是

A. 四种金属的难溶氢氧化物中Ksp[Mg(OH)2]最大
B. 可以通过调节pH的办法沉淀Fe3+
C. pM、Ksp及pH之间的关系为pM=npH+lgKsp-14n
D. Fe2+和Mg2+混合溶液中滴入NaOH溶液、当Mg2+开始沉淀时,溶液中![]()
【答案】C
【解析】A. pM=-lgc(Mn+),根据图像,在pM=6时,溶液中的氢离子的浓度分别为:10-3 mol/L,10-7 mol/L,10-9mol/L,10-11 mol/L,c(OH-)分别为10-11 mol/L,10-7 mol/L,10-5mol/L,10-3 mol/L,Ksp[Fe(OH)3]= 10-6×(10-11)3=10-37,Ksp[Cu(OH)2]= 10-6×(10-7)2=10-20,Ksp[Fe(OH)2]= 10-6×(10-5)2=10-16,Ksp[Mg(OH)2]= 10-6×(10-3)2=10-12,四种金属的难溶氢氧化物中Ksp[Mg(OH)2]最大,故A正确;B.c(Mn+)≦10-6mol/L认为该金属离子沉淀完全,根据图像,pH=3时Fe3+形成沉淀,因此可以通过调节pH的办法沉淀Fe3+,故B正确;C. pM=-lgc(Mn+)=-lg![]() =-[lgKsp-nlg c(OH-)]=- lgKsp+ nlg c(OH-)=- lgKsp+ nlg
=-[lgKsp-nlg c(OH-)]=- lgKsp+ nlg c(OH-)=- lgKsp+ nlg![]() =- lgKsp+ n(-14-pH)= -npH-lgKsp-14n,故C错误;D. Fe2+和Mg2+混合溶液中滴入NaOH溶液、当Mg2+开始沉淀时,溶液中
=- lgKsp+ n(-14-pH)= -npH-lgKsp-14n,故C错误;D. Fe2+和Mg2+混合溶液中滴入NaOH溶液、当Mg2+开始沉淀时,溶液中![]() =
=![]() =
=![]() ,故D正确;故选C。
,故D正确;故选C。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
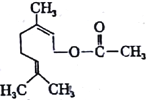
①1mol该有机物可消耗3molH2;②不能发生银镜反应;③分子式为C12H20O2;④它的同分异构体中可能有酚类;⑤1mol该有机物水解时只能消耗1molNaOH
A. ②③⑤ B. ①④⑤ C. ①②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列生活中常见物质的俗名与化学式相对应的是( )
A.酒精—C2H5OHB.胆矾—CuSO4C.苏打—NaHCO3D.生石灰—Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素各项性质比较正确的是
A. 金属性由强到弱:Na>K>Cs
B. 最高正价由高到低:O>N>C
C. 晶格能由大到小:NaF>NaCl>NaBr
D. 原子半径由大到小:F>Cl>Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
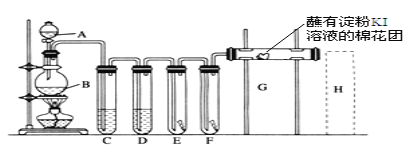
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式_____________。
(2)D中放入浓H2SO4,其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论及解释是________________________________。
(4)G处的现象是____________________________________。
(5)画出H处尾气吸收装置图并注明试剂____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式__________。
②需“密闭保存”的原因____________________________________________。
(7)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。亚硫酸钠将水中多余次氯酸除去的离子反应方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C2H6O存在两种结构C2H5OH和CH3OCH3。分子式为C5H12O且不能和金属钠反应放出氢气的有机物有(不考虑立体异构)( )
A. 5种 B. 6种
C. 7种 D. 8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧时产生大量SO2、NO对坏境影响极大。
(1)使用清洁能源可有效减少SO2等的排放。煤的液化是现代能源工业中重点推广的能源综合利用方案,最常见的液化方法为用煤生产CH3OH。已知制备甲醇的有关化学反应及平衡常数如下:
i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-90.8kJ/mol
CH3OH(g)+H2O(g) △H1=-90.8kJ/mol
ii:C0(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2kJ/mol
CO2(g)+H2(g) △H2=-41.2kJ/mol
iii:CO(g)+2H2(g)![]() CH3OH(g) △H3
CH3OH(g) △H3
850℃时,三个反应的平衡常数分别为K1=160、K2=243、K3=160。甲醇还可以与乙酸反应制香料,反应为:CH3OH(l)+CH3COOH(l)![]() CH3COOCH3(l)+H2O(l)
CH3COOCH3(l)+H2O(l)
①△H3=_______制香料反应的平衡常数K 的表达式为____________。
②850℃时,在密闭容器中进行反应i,开始时只加入CO2、H2,反应10min后测得各组分的浓度如下表。比较正、逆反应的速率的大小:V正_____V逆 (填“>”、“<”或“=”)。
物质 | H2 | CO2 | CH3OH | H2O |
浓度/mol/L | 0.2 | 0.2 | 0.4 | 0.4 |
(2)研究人员发现,将煤炭在O2/CO2的气氛下燃烧,能够降低然煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,如图为容器内的压强(p)与起始压强(p0)的比值(p/p0)随时间的变化曲线。
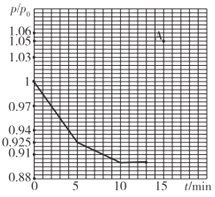
①0~5min内,该反应的平均反应速率V(N2)=______;平衡时NO的转化率为________。
②若13min时,向该容器中再充入0.06molCO,15min时再次达到平衡,此时容器内p/p0的比值应在图中A点的______(填"上方”或“方”)。
(3)以连二硫酸盐(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO),装置如图所示:

①阴极区的电极反应式为_________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com