
����Ŀ����������ʮ�����ʣ����Ҵ� ��ͭ ��CaO ��CO2 ��ʳ�� ��Ba(OH)2�ߺ��ɫ������������ �ఱˮ ��ϡ���� ��������
��1�������ʵķ������д����Ŀհ״���
����� | _______ | ������ | _____ | _____ | ����� | �ǵ���� |
���� | �� | _____ | �ݢ�� | �� | _____ | _____ |
��2������ʮ������������������֮��ɷ������ӷ�Ӧ��OH��+ H��=H2O���÷�Ӧ��Ӧ�Ļ�ѧ����ʽΪ________________________________��
��3�������Ģڼ������Һ�з�Ӧ������ӷ���ʽΪ____________________________��
���𰸡��������ʣ����ʣ� ��Һ ���� �ۢ� �ۢޢ� �٢� Ba(OH)2+2HNO3=Ba(NO3)2+2H2O 2Fe3��+Cu=2Fe2��+Cu2��
��������
�Ţ�ͭ�ǽ������ʣ���ʳ�ס��ఱˮ����ϡ����������Һ���ߺ��ɫ���������������ڽ��壬��CaO �� ��CO2 �����������CaO����Ba(OH)2 �������������ڵ���ʣ����Ҵ�����CO2 ���ڷǵ���ʣ��ʴ�Ϊ���������ʣ����ʣ�����Һ�����壬 �ۢܣ��ۢޢ⣬�٢ܣ�
�����ӷ���ʽ![]() ��ʾ�����Ե�ǿ��ǿ�Ӧ���ɿ������ε��кͷ�Ӧ�������Ǣ�Ba(OH)2 ���ϡ����ķ�Ӧ����Ӧ����ʽΪ��
��ʾ�����Ե�ǿ��ǿ�Ӧ���ɿ������ε��кͷ�Ӧ�������Ǣ�Ba(OH)2 ���ϡ����ķ�Ӧ����Ӧ����ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
�Ǣ�ͭ���뵽���������з����ķ�Ӧ����ʽΪ��![]() дΪ���ӷ���ʽ��
дΪ���ӷ���ʽ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ����(����)
A.�������ᷴӦ��2Fe+6H+==2 Fe3++ H2��
B.���Ȼ�����Һ�еμӹ����İ�ˮ��Al3++4 OH���T AlO![]() +2 H2O
+2 H2O
C.���Ȼ�����Һ�м������ۣ�Fe3+��Fe��2Fe2+
D.�Ȼ�����Һ������������Һ��Ӧ��Fe3++3OH���T Fe��OH��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ˮ��Һ�д��ڵ���ƽ�⡢ˮ��ƽ�⡢�ܽ�ƽ�⣬��ش��������⡣
��1����֪��������ĵ��볣�������
���� | CH3COOH | HCN | H2CO3 |
���볣��(25��) | Ka= 1.8��10-5 | Ka=4.3��l0-10 | Ka1=5.0��l0-7Ka2=5.6��l0-11 |
��0.1moI/LNaCN��Һ��0.1mol/LNaHCO3��Һ�У�c(CN-)___c(HCO3-)(����>������<������=��)��
�ڳ����£����ʵ���Ũ����ͬ��������Һ��A��CH3COONa B��NaCN C��Na2CO3����pH�ɴ�С��˳����___(����)��
�۽�����CO2ͨ��NaCN��Һ����Ӧ�����ӷ���ʽ��_____��
�������£�����Ũ�ȵ�CH3COONa��ҺpH=9�������ӷ���ʽ��ʾ��Һ�ʼ��Ե�ԭ����_____����Һ��c(CH3COO-)/c(CH3COOH)=____��
��2��ij�¶��£�pH=3��������[OH-]=10-9mol/L�����¶��£� pH=2��H2SO4��pH=11��NaOH��Ϻ�pH��Ϊ9�����������������Ƶ������Ϊ____��
��3�������£���0.100mol/L������Һ�ζ�20.00mL0.l00mol/L��ij��ˮ��Һ���ζ�������ͼ��ʾ��������Ϊ������������
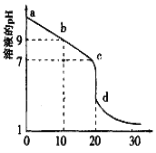
��d����ʾ����Һ������Ũ���ɴ�С��˳������Ϊ______��
��b����ʾ����Һ��c(NH4+)��c(NH3��H2O)=_____(д��ȷ��ֵ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��пŦ�۵�صķŵ練Ӧ��Zn+Ag2O+H2O=Zn(OH)2+2Ag������Ag2O��������������ԭ��Ӧ
B. ͨ������ԭ��أ��ܽ���Ӧ�Ļ�ѧ��ȫ��ת��Ϊ����
C. ��ͼԭ����У���ع���ʱ��SO42-�����ص�����
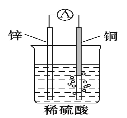
D. ����ԭ��ص������缫�����ǻ����Բ�ͬ�����ֽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. Cl2ͨ��ˮ�У�Cl2+H2O = 2H++Cl-+ClO-
B. ˫��ˮ����ϡ�����KI��Һ��H2O2��2H����2I��=I2��2H2O
C. ��ͭ���缫���CuSO4��Һ��2Cu2����2H2O![]() 2Cu��O2����4H��
2Cu��O2����4H��
D. Na2S2O3��Һ�м���ϡ���2S2O32����4H��=SO42����3S����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na��Ũ��Ϊ0.5 mol��L��1��ij������Һ�У������ܻ���K����Ag����Ca2����Ba2����NO3����CO32����SiO32����SO42���е������֣���ȡ����Һ100mL��������ʵ��
��֪��H2SiO3Ϊ����ˮ�Ľ�״����������ʱ�ֽ�Ϊ��������
��� | ʵ������ | ʵ���� |
�� | �����Һ�м�������ϡ���� | ���ɰ�ɫ��״�������ų������0.56L���� |
�� | �����в����Ļ��Һ���ˣ��Գ���ϴ�ӡ����������أ��������ù������� | ��������Ϊ2.4g |
�� | ������Һ�еμ�BaCl2��Һ | ���������� |
��ش��������⣺
��1��ʵ�����ȷ��һ�����ڵ�������______________��һ�������ڵ�������____________��
��2��ʵ����г���ϴ�ӡ����������أ����漰�Ļ�ѧ����ʽΪ____________________��
��3��ͨ��ʵ���ͱ�Ҫ���㣬��K+����СŨ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ijЩ���ӵļ���˵������ȷ����
A.��ij��Һ�м�ϡ���ᣬ�ܲ�������ʯ��ˮ����ǵ���ɫ����ζ�����壬�����Һ��һ����CO32��
B.��ij��Һ�м���BaCl2��Һ�а�ɫ�����������ټ����ᣬ��������ʧ�������Һ��һ����SO42��
C.��ij��Һ�м���ŨNaOH��Һ�����ȣ��ܲ���ʹʪ��ĺ�ɫʯ����ֽ���������壬�����Һһ����NH4��
D.��ij��Һ�м���AgNO3��Һ������ɫ�����������Һ��һ������Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ȼ�����������������Ӧ�ù㷺��
��1���Ȼ�����ˮ���γɾ��о�ˮ���õ������������壬�䷴Ӧ�����ӷ���ʽΪ___________��
��2����ҵ������������Ҫ�ɷ�ΪAl2O3������Fe2O3 ��SiO2�����ʣ���ȡ��ˮ�Ȼ�����һ�ֹ�������ʾ�����£�
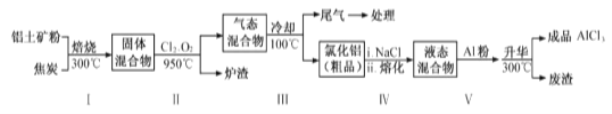
��֪��

�ٲ�����б���ʹ����ˮ�ֻӷ���������Ŀ���࣬��������_____��ֻҪ��д��һ�֣���
�ڲ����������ͨ����������������Ӧ�������ԭ�������ȹ��ĵ�����_____��
�۲�����β������ȴ�����º�������������NaOH����Һ���գ����ɵ�����Ҫ��3�֣��仯ѧʽ�ֱ�Ϊ_________________________��
�ܽ�����̼�������ݷ�����������м������۵�Ŀ����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
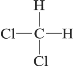
����Ŀ�����и������ʻ�Ϊͬ���칹����ǣ� ��
A. CH3��CH3��CH3��CH2��CH3
B. 12C��14C
C. CH3��CH2��CH2��CH3��(CH3)2CHCH3
D.  ��
�� 
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com