
【题目】A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列推断正确的是( )
![]()
A. X元素为铝
B. 反应①和②互为可逆反应
C. X元素可能是金属,也可能是非金属
D. 反应①和②一定为氧化还原反应
【答案】D
【解析】A单质与强碱发生反应,生成了两种产物B和C,而且B和C均含有同一种元素,且B和C又可以在强酸的作用下发生反应,生成单质A,可以看出反应①是A物质的歧化反应,反应②应该是这种元素的归中反应,所以B和C中应该分别含有A的负价态物质以及正价态物质,判断A一定是非金属元素。A、①应该是A物质的歧化反应,反应②应该是一种元素的归中反应,则可以知道B和C中应该分别含有A的负价态物质以及正价态物质,可以判断A不可能是金属,故A错误;B、可逆反应的定义是指在同一条件下,既能向正反应方向进行,同时又能向逆反应的方向进行的反应,叫做可逆反应,上述①②两个反应的反应条件不相同,不是可逆反应,故B错误;C、转化关系中A+OH-→B+C,B+C→A,ABC中都含有X元素,发生的是同种元素间的歧化反应和归中反应,元素有负价只能是非金属,因为金属元素无负价,说明X元素是非金属元素,故C错误;D、转化关系中A+OH-→B+C,B+C→A,因为归中反应和歧化反应均有价态的变化,判断可知,①和②的确为氧化还原反应,故D正确;故选D。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金是重要的金属材料.
(1)下列物品所使用的主要材料属于合金的是(填字母序号,下同).
A.青花瓷瓶
B.橡胶充气艇
C.不锈钢锅
(2)生铁是常用的合金,生铁属于(填“纯净物”或“混合物”).
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,说明 .
(4)黄铜渣中约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为杂质.处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应): 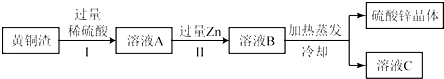
已知:ZnO+H2SO4═ZnSO4+H2O; CuO+H2SO4═CuSO4+H2O
①Ⅱ中反应的化学方程式为;
②下列说法正确的是 .
a.Ⅰ、Ⅱ中的操作均包含过滤 b.溶液A中ZnSO4的质量大于CuSO4
c.溶液A 的质量小于溶液B d.溶液C中溶质的质量分数小于溶液B.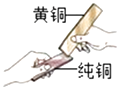
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1。我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg·L-1。水中溶解氧的测定步骤如下:
(1)向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;
(2)加入适量稀H2SO4,搅拌,等MnO(OH)2与I-完全反应生成Mn2+和I2后;
(3)用Na2S2O3标准溶液滴定至终点。
测定过程中物质的转化关系如下:
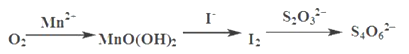
已知:MnO(OH)2+2I-+4H+ =Mn2++I2+3H2O 2S2O32- +I2= S4O62-+2I-
①加入稀硫酸后搅拌的作用是__________;Na2S2O3标准溶液应装在______________滴定管中(填酸式或碱式)。
②滴定过程中以_____________为指示剂;达到滴定终点的标志为____________________。
③写出O2将Mn2+氧化成MnO(OH)2的离子方程式____________________;
④若加入的稀H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差。写出产生误差的一个原因(用离子方程式表示)__________________。
⑤下列操作使测得水样中溶氧量(DO)比实际值偏高的是__________________。
A.第(1)步操作静置时没有密封 B.装Na2S2O3标准溶液的滴定管没有润洗
C.滴定前锥形瓶洗净后没有干燥 D.滴定前读数正确,滴定后俯视读数
⑥取加过一定量CaO2·8H2O的池塘水样l00.00mL,按上述方法测定水中溶解氧量,消耗0.01000
mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧为____________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解反应2N2O5(g)![]() 4NO2(g) + O2(g)的速率方程式v = k·cm(N2O5),k是与温度有关的常数,实验测定340K时的有关数据及根据相关数据做出的图像如下:
4NO2(g) + O2(g)的速率方程式v = k·cm(N2O5),k是与温度有关的常数,实验测定340K时的有关数据及根据相关数据做出的图像如下:
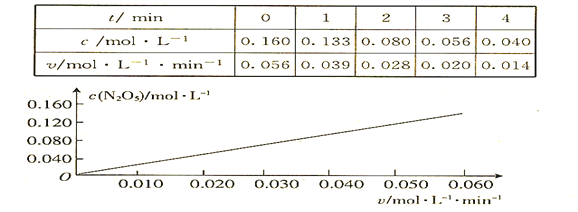
依据图表中的有关信息,判断下列有关叙述中不正确的是
A. 340K时,速率方程式中的m = 1
B. 340K时,速率方程式中的k = 0.350 min-1
C. 340K时,c(N2O5)= 0.100 mol·l-1时,v = 0.035 mol·l-1 ·min-1
D. 340K时,压强增大一倍,逆反应速率不变,正反应速率是原来的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以按一定比例混合,在120℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中能符合此条件的是
A. C2H6 C2H4 B. CH4 C3H6 C. C2H2 C3H4 D. C2H2 C3H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com