
(16分)A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与 B 的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素,请回答。
(1)D在元素周期表中的位置是 。
(2)C2B的电子式是 ;AB2的结构式是 。
(3)B、C、E离子半径的由大到小的顺序为 ;(用离子符号回答)A、D、E最高价氧化物对应水化物的酸性由强到弱的顺序为 。(用化学式回答)
(4)A、B气态氢化物沸点高的是 ;(用化学式回答)原因 。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来出去水中超标的Mn2+,生成黑色沉淀,当消耗13.50 g EB2时,共转移了1 mol电子,则反应的离子方程式为 。
(1)第三周期第ⅣA族 (2) ; O=C=O
; O=C=O
(3)Cl->O2->Na+ HClO4>H2CO3>H2SiO3
(4)H2O>CH4 ;水分子间形成氢键,可以使水沸点反常升高。
(5)2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+
【解析】
试题分析:根据题意可推知:A是C;B是O;C是Na;D是Si;E是Cl。(1)D由于原子核外电子排布是2、8、4,所以在元素周期表中的位置是第三周期第ⅣA族,(2)Na2O的电子式是 ; CO2是共价化合物,其结构式是O=C=O;(3)B、C的核外电子排布是2、8,核电荷数越大,离子半径就越小,而E离子核外电子排布是2、8、8,离子核外电子层数越多,离子半径就越大,所以B、C、E半径的由大到小的顺序为Cl->O2->Na+;A、D、E三种元素的非金属性强弱顺序是:Cl>C>Si,元素的非金属性越强,元素最高价氧化物对应水化物的酸性就越强,所以酸性由强到弱的顺序为HClO4> H2CO3>H2SiO3;(4)A、B气态氢化物沸点高的是H2O,原因是在水分子间形成氢键,可以使物质的分子间作用力增强,物质的熔沸点升高,水沸点反常升高。(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,ClO2可以用来出去水中超标的Mn2+,生成黑色沉淀,当消耗13.50 g ClO2时,共转移了1 mol电子,由于n(ClO2)= 13.50 g÷67.5g/mol=0.2mol反应转移电子1mol,所以每1mol的ClO2反应,转移电子5mol,产生的黑色含有Mn元素的难溶性的物质是MnO2,根据氧化还原反应中电子转移的数目相等,结合质量守恒定律可得反应的离子方程式为2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+。
; CO2是共价化合物,其结构式是O=C=O;(3)B、C的核外电子排布是2、8,核电荷数越大,离子半径就越小,而E离子核外电子排布是2、8、8,离子核外电子层数越多,离子半径就越大,所以B、C、E半径的由大到小的顺序为Cl->O2->Na+;A、D、E三种元素的非金属性强弱顺序是:Cl>C>Si,元素的非金属性越强,元素最高价氧化物对应水化物的酸性就越强,所以酸性由强到弱的顺序为HClO4> H2CO3>H2SiO3;(4)A、B气态氢化物沸点高的是H2O,原因是在水分子间形成氢键,可以使物质的分子间作用力增强,物质的熔沸点升高,水沸点反常升高。(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,ClO2可以用来出去水中超标的Mn2+,生成黑色沉淀,当消耗13.50 g ClO2时,共转移了1 mol电子,由于n(ClO2)= 13.50 g÷67.5g/mol=0.2mol反应转移电子1mol,所以每1mol的ClO2反应,转移电子5mol,产生的黑色含有Mn元素的难溶性的物质是MnO2,根据氧化还原反应中电子转移的数目相等,结合质量守恒定律可得反应的离子方程式为2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+。
考点:考查元素的推断、元素在周期表中的位置、物质的电子式、结构式、离子半径的比较、物质的酸碱性和熔沸点的比较、氧化还原反应的两种方程式的书写的知识。


科目:高中化学 来源:2014-2015学年四川省高一10月月考化学试卷(解析版) 题型:选择题
能把K2SO4、Ba(NO3)2、Na2CO3三种无色溶液鉴别出来的一种试剂是
A.KNO3溶液 B.稀硫酸 C.NaOH 溶液 D.Na2SO4溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川成都树德协进中学高二10月阶段性考试化学试卷(解析版) 题型:填空题
(12分)根据已学知识,回答下列问题:
(1)具有(n-1)d10n s2电子构型的元素位于周期表中 区和族。
(2)写出3P轨道上有2个未成对电子的元素名称:。
(3)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素X,该元素的价电子排布式为3d54s1,该元素可与氧元素形成离子X2O72-,K2X2O7氧化浓盐酸生成氯气的同时还生成了X3+,写出该反应的离子方程式 。
(4)键能是指气态基态原子形成1 mol化学键释放的最低能量。某些化学键的键能如下表
格所示(单位:kJ·mol-1):
键 | H—H | N | O=O | F—F | H—Cl |
键能 | 436 | 946 | 498 | 157 | 431 |
键 | N—N | P—P | P—O | Cl—Cl | Br—Br |
键能 | 193 | 198 | 360 | 242.7 | 193 |
①由表中所列化学键形成的单质分子中,最不稳定的是。
②通过表中键能数据,计算说明N2分子中的键比键稳定(填“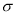 ”或“
”或“ ”)。
”)。
③化学反应的实质是旧化学键断裂和新化学键形成的过程。现有化学反应方程式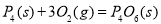 ,通过计算可以确定,1molP4(s)参加该反应, (填“吸收”或“放出”)的热量为kJ。
,通过计算可以确定,1molP4(s)参加该反应, (填“吸收”或“放出”)的热量为kJ。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川成都树德协进中学高二10月阶段性考试化学试卷(解析版) 题型:选择题
下列化合物分子中一定既含单键又含双键的是
A.CO2 B. H2O2 C. C2H2 D. COCl2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川成都树德协进中学高二10月阶段性考试化学试卷(解析版) 题型:选择题
下列说法中不正确的是
A.处于最低能量的原子叫做基态原子
B.4f 4表示4f能级有四个轨道
C.同一原子中,2p、3d、4f能级的轨道数依次增多
D.同一原子中,2p、3p、4p电子的能量逐渐增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春市新高三起点调研考试化学试卷(解析版) 题型:选择题
如图是立方烷的球棍模型,下列有关说法不正确的是

A.其一氯代物只有一种
B.其二氯代物有三种同分异构体
C.它的分子式不符合CnH2n+2,所以它不是饱和烃
D.它与苯乙烯(C6H5—CH=CH2)互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春市新高三起点调研考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
B.能自发进行的化学反应,一定是△H<0、△S>0
C.焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化
D.钢铁发生电化学腐蚀时,负极的电极反应式为 Fe–3e- = Fe3+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
下列说法中不正确的是
A.食醋中含有乙酸,乙酸可由乙醇氧化得到
B.乙醇、乙酸乙酯、乙酸能用饱和碳酸钠溶液鉴别
C.乙酸、乙酸乙酯、葡萄糖和淀粉的最简式相同
D.生活中食用的食醋、植物油、动物蛋白等都是混合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高二上学期期中考试化学试卷(解析版) 题型:填空题
(6分)化学反应 2A+B?2C;△H<0达到化学平衡时,根据以下条件改变填空:
(1)若A、B、C都是气体,且C为有色气体.
①及时分离出C,平衡 移动;(填正向、逆向、不)
②使密闭容器体积增大,A的转化率 ;(填增大、减小、不变)
③如果升高温度,平衡混合物的颜色 ;(填加深、变浅、不变)
④加入催化剂D,平衡 移动;(填正向、逆向、不)
(2)若A、C为气体,B为固体;
①加压,则A的体积分数 ;(填增大、减小、不变)
②增加B的量,A的转化率 .(填增大、减小、不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com