
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是
A. 异戊二烯(![]() )与等物质的量的Br2加成
)与等物质的量的Br2加成
B. 2-氯丙烷与NaOH的乙醇溶液共热发生消去反应
C. 甲苯在一定条件下发生硝化反应生成一硝基甲苯
D. 丙炔与足量的氯化氢在一定条件生成二氯代物
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)KAl(SO4)2的电离方程式_________。
(2)向石蕊试液中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是_________、_________ (填微粒符号)。
(3)实验室需配制0.5mol/L的硫酸溶液480mL,在下图所示仪器中,配制上述溶液肯定不需要的是___(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________。
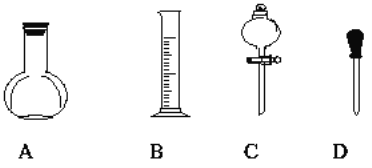
(4)化学方程式H2S+H2SO4(浓)=SO2↑+S↓+2H2O,当生成4.48L(标况)SO2时,转移的电子是__________mol。
(5)下列四个图像中,横坐标表示加入物质的物质的量,纵坐标表示生成沉淀的量或产生气体的量,从A~D中选择符合各题要求的序号填人表中。
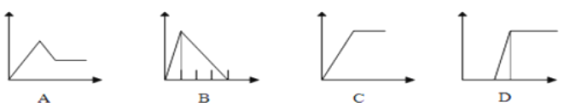
溶液 | 加入的物质 | 序号 |
①AlCl3溶液 | 通入过量的NH3 | ___ |
②Na2CO3和NaOH的溶液 | 滴入过量的盐酸 | ___ |
③NaAlO2溶液 | 滴加稀硫酸至过量 | __ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
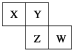
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性Z比W强
C. Y的气态氢化物的稳定性较Z的弱
D. 四种元素的单质中,Z的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 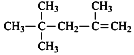 的一氯代物有4种
的一氯代物有4种
B. 异丙苯苯环上的二氯代物有6种
C. ![]() 的同分异构体属芳香烃且含相同官能团的有3种
的同分异构体属芳香烃且含相同官能团的有3种
D. 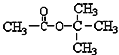 在核磁共振氢谱中能出现两个峰,且其峰面积之比为1:3
在核磁共振氢谱中能出现两个峰,且其峰面积之比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料](NH4)2SO4在260℃和400℃时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
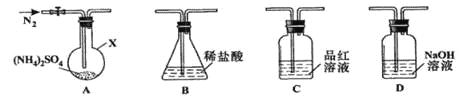
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO42-。
(1)仪器X的名称是________________;
(2)滴定前,下列操作的正确顺序是_________(填字母编号);
a.盛装0.2000mol/L NaOH溶液
b.用0.2000mol/L NaOH溶液润洗
c.读数、记录
d.查漏、清洗
e.排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是__________mol,
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________;
(5)装置B内溶液吸收的气体是____________;
(6)(NH4)2SO4在400℃分解的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下:C6H5-CH3+2KMnO4![]() C6H5-COOK+KOH+2MnO2↓+H2O,C6H5-COOK+HCl→C6H5-COOH+KCl,已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3g和6.9g。
C6H5-COOK+KOH+2MnO2↓+H2O,C6H5-COOK+HCl→C6H5-COOH+KCl,已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3g和6.9g。
(制备产品)30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在80℃下反应30min,装置如图所示:
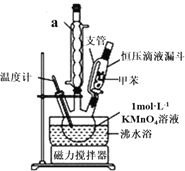
(1)仪器a的名称是___,图中支管的作用是______;
(2)相对于用酒精灯直接加热,用沸水浴加热的优点是_____,在本实验中,三颈烧瓶最合适的容积是___(填字母);
A.50mL B.100mL C.200mL D.250mL
(分离产品)他们设计如下流程分离粗产品苯甲酸和回收甲苯:

(3)操作Ⅰ的名称是____;含杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是_____;
(4)操作Ⅲ的名称是_____,固体B中可能会有________杂质离子,检验该离子的方法是_________;提纯B所用的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用稀硝酸与铜反应制备NO气体,如果采用图Ⅰ装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不是十分理想,因为观察到的现象不能有力证明反应产物是NO。有人设计了图Ⅱ装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。
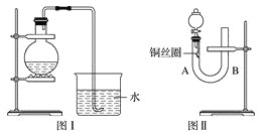
(1)用图Ⅰ装置做实验时,用排水法收集到的气体的颜色为_____色;实验过程中由于______,不易观察到____________生成,从而不能有力证明反应产物是NO。
(2)用图Ⅱ装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到____________为止。
②关闭活塞,用酒精灯在U形管的A侧加热,当______时,立即撤去酒精灯。
(3)根据图Ⅱ装置的实验完成下列问题:
①反应在什么情况下可以自动停止?________________________。
可在何处观察到无色的NO气体?____________________________________________。
②如果将分液漏斗的活塞慢慢打开,可立即观察到哪些明显现象?_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
B. 往碳酸镁中滴加稀盐酸:CO32-+2H+===CO2↑+H2O
C. 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
D. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-===BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com