
【题目】在标准状况下,将33.6L HCl气体溶于H2O中配成0.5L溶液。(要求有解题过程,无解题过程不给分)
(1)该盐酸的物质的量浓度为多少_____?
(2)取这种盐酸100mL,稀释到500mL,所得的稀盐酸的物质的量浓度为多少____?
【答案】标况下, ![]()
该盐酸物质的量浓度为: ![]() 稀释前后溶质物质的量不变,由稀释公式:
稀释前后溶质物质的量不变,由稀释公式:
c(浓)·V(浓) = c(稀)·V(稀)
3mol/L×0.1L = c(HCl)稀×0.5 L
所得稀盐酸的物质的量浓度为:c(HCl)稀=0.6mol/L
【解析】
(1) 标准状况下33.6L 氯化氢气体物质的量为n![]() =33.6L
=33.6L![]() 22.4L
22.4L![]() mol-1=1.5mol;c
mol-1=1.5mol;c![]() 0.5L=
0.5L=![]() ;答案标况下,
;答案标况下, ![]() ,该盐酸物质的量浓度为:
,该盐酸物质的量浓度为: ![]() 。
。
(2) 取这种盐酸100mL,稀释到![]() , 根据稀释定律,稀释前后溶质的物质的量不变,则所得的稀盐酸的物质的量浓度为c
, 根据稀释定律,稀释前后溶质的物质的量不变,则所得的稀盐酸的物质的量浓度为c![]() 100mL
100mL![]() )
)![]() =0.6mol/L。答案:稀释前后溶质物质的量不变,由稀释公式: c(浓)·V(浓) = c(稀)·V(稀) 3mol/L×0.1L = c(HCl)稀×0.5 L ,所得稀盐酸的物质的量浓度为:c(HCl)稀=0.6mol/L
=0.6mol/L。答案:稀释前后溶质物质的量不变,由稀释公式: c(浓)·V(浓) = c(稀)·V(稀) 3mol/L×0.1L = c(HCl)稀×0.5 L ,所得稀盐酸的物质的量浓度为:c(HCl)稀=0.6mol/L


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】相对分子质量为M的气态化合物VL(标准状况)溶于mg水中,得到溶液的质量分数为ω%,物质的量浓度cmol/L,密度为ρg/cm3,则下列说法正确的是
A. 相对分子质量M可表示为:![]()
B. 溶液密度ρ可表示为:![]()
C. 溶液的质量分数ω%可表示为:![]()
D. 物质的量浓度C可表示为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用如图所示装置(夹持装置略)收集某葡萄酒中SO2,采用H2O2氧化法检测二氧化硫的含量,并对H2O2的催化分解原理进行分析。
已知:H2O2可看作二元弱酸,它的一级电离常数Ka1=1.55×10-12

Ⅰ.检测二氧化硫的含量
(1)仪器A的名称是_______________。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中过量H2O2溶液充分反应,C中发生反应的化学方程式为__________________________。
(3)用0.0900mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________(填编号)。向C中所得溶液中滴加几滴酚酞试剂,滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_____g·L-1。
(4)该测定结果比实际值偏高,分析原用可能是_____________(任答一条即可),
(5)本实验中所用的H2O2溶液的浓度,常用KMnO4标准溶液进行测定,H2O2可看作二元弱酸,但一般不利用酸碱中和滴定法过行测定的原因_______________任答一条即可)。
Ⅱ.分析H2O2的催化分解原理
(1)碱性介质中H2O2分解远比酸性介质中快,NaOH可促使H2O2失去质子,请写出H2O2与NaOH溶液反应生成的酸式盐的电子式___________________。
(2)I-催化H2O2分解的原理分为两步,总反应可表示为:
2H2O2(aq)=2H2O(l)+O2(g) △H<0
若第一步反应为H2O2(aq)+I-(aq)=IO-(aq)+H2O(l) △H>0 慢反应
则第二步反应为____________△H <0 快反应
(3)能正确的表示I-催化H2O2分解真理的示意图为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X溶液中加入Y试剂,产生沉淀或气体如图,与所述情形几乎完全相符的是( )

A. 向HCl和AlCl3的混合液滴加NaOH溶液 B. 向NH4Al(SO4)2 溶液滴加 Ba(OH)2溶液
C. 向NaOH和Ca(OH)2混合液中通入CO2 D. 向NaOH和Na2CO3混合液滴加稀HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组探究实验室中制备Cl2的过程,为证明过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如下图所示的实验装置,按要求回答问题。
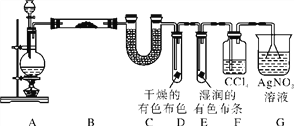
(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是________________________。
(2)①装置B中盛放的试剂名称为_______,作用是___________,现象是___________。
②装置D和E中出现的不同现象说明的问题是_______________________________。
③装置F的作用是____________________。
④写出装置G中发生反应的离子方程式:__________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应加入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列问题,与盐类水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂
②NaHCO3与Al2(SO4)3两种溶液用于制造泡沫灭火器
③将含有CaSO4的水垢用Na2 CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②⑤ B. ②③④ C. ①②④⑤ D. ①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com