
ЎҫМвДҝЎҝҪьЖЪҝЖСРИЛФұ·ўПЦБЧЛбВИаӯөИТ©Оп¶ФРВРН№ЪЧҙІЎ¶ҫ·ОСЧ»јХЯБЖР§ПФЦшЎЈБЧЛбВИаӯЦРјдМеәПіЙВ·ПЯИзПВЈә
ТСЦӘЈәўс.ВұФӯЧУОӘұҪ»·өДБЪ¶ФО»¶ЁО»»щЈ¬Ль»бК№өЪ¶юёцИЎҙъ»щЦчТӘҪшИлЛьөДБЪ¶ФО»Ј»Пх»щОӘұҪ»·өДјдО»¶ЁО»»щЈ¬Ль»бК№өЪ¶юёцИЎҙъ»щЦчТӘҪшИлЛьөДјдО»ЎЈ
ўт. EОӘЖыіө·А¶іТәөДЦчТӘіЙ·ЦЎЈ
ўу. 2CH3COOC2H5![]() CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH
Зл»ШҙрПВБРОКМв
(1)РҙіцBөДГыіЖ__________Ј¬CЎъDөД·ҙУҰАаРНОӘ_____________ Ј»
(2)РҙіцEЙъіЙFөД»ҜС§·ҪіМКҪ___________________________ЎЈ
РҙіцHЙъіЙIөД»ҜС§·ҪіМКҪ__________________ЎЈ
(3)1 mol JФЪЗвСх»ҜДЖИЬТәЦРЛ®ҪвЧо¶аПыәД________mol NaOHЎЈ
(4)HУР¶аЦЦН¬·ЦТм№№МеЈ¬ЖдВъЧгПВБРМхјюөДУР_________ЦЦ(І»ҝјВЗКЦРФТм№№)Ј¬ЖдЦРәЛҙЕ№ІХсЗвЖЧ·еГж»эұИОӘ1Јә1Јә2Јә6өДҪб№№јтКҪОӘ___________ЎЈ
ўЩЦ»УРБҪЦЦә¬Сх№ЩДЬНЕ
ўЪДЬ·ўЙъТшҫө·ҙУҰ
ўЫ1 mol ёГОпЦКУлЧгБҝөДNa·ҙУҰЙъіЙ0.5 mol H2
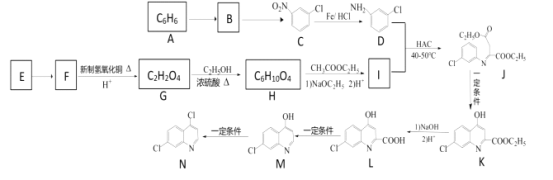
(5)ТФПх»щұҪәН2-¶ЎП©ОӘФӯБПҝЙЦЖұё»ҜәПОпЈ¬![]() әПіЙВ·ПЯИзНјЈә
әПіЙВ·ПЯИзНјЈә
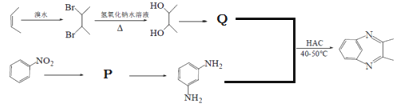
РҙіцPЎўQҪб№№јтКҪЈәP_______Ј¬Q________ЎЈ
Ўҫҙр°ёЎҝПх»щұҪ »№Фӯ·ҙУҰ HOCH2-CH2OH+O2![]() OHCЎӘCHO+2H2O
OHCЎӘCHO+2H2O ![]() +CH3COOC2H5
+CH3COOC2H5![]() C2H5OOCCOCH2COOC2H5+C2H5OH 4 12
C2H5OOCCOCH2COOC2H5+C2H5OH 4 12 ![]() Ўў
Ўў![]()
![]()
ЎҫҪвОцЎҝ
A·ЦЧУКҪКЗC6H6Ј¬ҪбәП»ҜәПОпCөДҪб№№ҝЙЦӘAКЗұҪЈ¬Ҫб№№јтКҪОӘ![]() Ј¬AУлЕЁПхЛбЎўЕЁБтЛб»мәПјУИИ·ўЙъИЎҙъ·ҙУҰІъЙъПх»щұҪЈ¬Ҫб№№јтКҪОӘ
Ј¬AУлЕЁПхЛбЎўЕЁБтЛб»мәПјУИИ·ўЙъИЎҙъ·ҙУҰІъЙъПх»щұҪЈ¬Ҫб№№јтКҪОӘ![]() Ј¬BУлТәВИФЪFeҙЯ»ҜПВ·ўЙъИЎҙъ·ҙУҰІъЙъCЈә
Ј¬BУлТәВИФЪFeҙЯ»ҜПВ·ўЙъИЎҙъ·ҙУҰІъЙъCЈә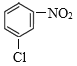 Ј¬CУлFeЎўHCl·ўЙъ»№Фӯ·ҙУҰІъЙъDЈә
Ј¬CУлFeЎўHCl·ўЙъ»№Фӯ·ҙУҰІъЙъDЈә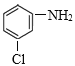 Ј»УЙУЪFУлРВЦЖCu(OH)2РьЧЗТә»мәПјУИИЈ¬И»әуЛб»ҜөГөҪ·ЦЧУКҪОӘC2H2O4өДGЈ¬ЛөГчFЦРә¬УР-CHOЈ¬Gә¬УР2ёц-COOHЈ¬ФтGКЗТТ¶юЛбЈәHOOC-COOHЈ¬ДжНЖFКЗТТ¶юИ©ЈәOHC-CHOЈ¬EОӘЖыіө·А¶іТәөДЦчТӘіЙ·ЦЈ¬ФтEКЗТТ¶юҙјЈ¬Ҫб№№јтКҪКЗЈәHOCH2-CH2OHЈ¬HOOC-COOHУл2ёц·ЦЧУөДCH3CH2OHФЪЕЁБтЛбЧчУГПВјУИИЈ¬·ўЙъхҘ»Ҝ·ҙУҰІъЙъ·ЦЧУКҪКЗC6H10O4өДHЈ¬HөДҪб№№јтКҪКЗC2H5OOC-COOC2H5Ј»HУлCH3COOC2H5·ўЙъIIIМхјюөД·ҙУҰІъЙъIЈәC2H5OOCCOCH2COOC2H5әНC2H5OHЈ¬IУлD·ҙУҰІъЙъJәНH2OЈ¬JФЪТ»¶ЁМхјюПВ·ҙУҰІъЙъJЈ¬K·ўЙъхҘөДЛ®Ҫв·ҙУҰЈ¬И»әуЛб»ҜҝЙөГLЈ¬L·ўЙъНСфИ·ҙУҰІъЙъMЈ¬MФЪТ»¶ЁМхјюПВ·ўЙъЛ®Ҫв·ҙУҰІъЙъNЈ¬ҫЭҙЛ·ЦОцҪвҙрЎЈ
Ј»УЙУЪFУлРВЦЖCu(OH)2РьЧЗТә»мәПјУИИЈ¬И»әуЛб»ҜөГөҪ·ЦЧУКҪОӘC2H2O4өДGЈ¬ЛөГчFЦРә¬УР-CHOЈ¬Gә¬УР2ёц-COOHЈ¬ФтGКЗТТ¶юЛбЈәHOOC-COOHЈ¬ДжНЖFКЗТТ¶юИ©ЈәOHC-CHOЈ¬EОӘЖыіө·А¶іТәөДЦчТӘіЙ·ЦЈ¬ФтEКЗТТ¶юҙјЈ¬Ҫб№№јтКҪКЗЈәHOCH2-CH2OHЈ¬HOOC-COOHУл2ёц·ЦЧУөДCH3CH2OHФЪЕЁБтЛбЧчУГПВјУИИЈ¬·ўЙъхҘ»Ҝ·ҙУҰІъЙъ·ЦЧУКҪКЗC6H10O4өДHЈ¬HөДҪб№№јтКҪКЗC2H5OOC-COOC2H5Ј»HУлCH3COOC2H5·ўЙъIIIМхјюөД·ҙУҰІъЙъIЈәC2H5OOCCOCH2COOC2H5әНC2H5OHЈ¬IУлD·ҙУҰІъЙъJәНH2OЈ¬JФЪТ»¶ЁМхјюПВ·ҙУҰІъЙъJЈ¬K·ўЙъхҘөДЛ®Ҫв·ҙУҰЈ¬И»әуЛб»ҜҝЙөГLЈ¬L·ўЙъНСфИ·ҙУҰІъЙъMЈ¬MФЪТ»¶ЁМхјюПВ·ўЙъЛ®Ҫв·ҙУҰІъЙъNЈ¬ҫЭҙЛ·ЦОцҪвҙрЎЈ
ёщҫЭЙПКц·ЦОцҝЙЦӘAКЗ![]() Ј¬BКЗ
Ј¬BКЗ![]() Ј¬EКЗHOCH2-CH2OHЈ¬FКЗOHCЎӘCHOЈ¬GКЗHOOC-COOHЈ¬HКЗC2H5OOC-COOC2H5Ј¬IКЗC2H5OOCCOCH2COOC2H5ЎЈ
Ј¬EКЗHOCH2-CH2OHЈ¬FКЗOHCЎӘCHOЈ¬GКЗHOOC-COOHЈ¬HКЗC2H5OOC-COOC2H5Ј¬IКЗC2H5OOCCOCH2COOC2H5ЎЈ
(1) BКЗ![]() Ј¬ГыіЖКЗПх»щұҪЈ»CКЗ
Ј¬ГыіЖКЗПх»щұҪЈ»CКЗ Ј¬CУлFeЎўHCl·ўЙъ»№Фӯ·ҙУҰІъЙъDЈә
Ј¬CУлFeЎўHCl·ўЙъ»№Фӯ·ҙУҰІъЙъDЈә Ј¬-NO2ұ»»№ФӯОӘ-NH2Ј¬·ҙУҰАаРНОӘ»№Фӯ·ҙУҰЈ»
Ј¬-NO2ұ»»№ФӯОӘ-NH2Ј¬·ҙУҰАаРНОӘ»№Фӯ·ҙУҰЈ»
(2) EКЗHOCH2-CH2OHЈ¬ә¬УРҙјфЗ»щЈ¬ҝЙТФФЪCuЧчҙЯ»ҜјБМхјюПВ·ўЙъСх»Ҝ·ҙУҰІъЙъТТ¶юИ©ЈәOHC-CHOЈ¬ЛщТФEЙъіЙFөД»ҜС§·ҪіМКҪКЗHOCH2-CH2OH+O2![]() OHC-CHO+2H2OЈ»
OHC-CHO+2H2OЈ»
HКЗC2H5OOC-COOC2H5Ј¬HУлCH3COOC2H5·ўЙъIIIМхјюөД·ҙУҰІъЙъIЈәC2H5OOCCOCH2COOC2H5әНC2H5OHЈ¬·ҙУҰ·ҪіМКҪОӘЈәC2H5OOC-COOC2H5+ CH3COOC2H5![]() C2H5OOCCOCH2COOC2H5+C2H5OHЈ»
C2H5OOCCOCH2COOC2H5+C2H5OHЈ»
(3)JҪб№№јтКҪКЗ![]() Ј¬ФЪJЦРә¬УР1ёцClФӯЧУБ¬ҪУФЪұҪ»·ЙПЈ¬Л®ҪвІъЙъHClәН·УфЗ»щЈ»ә¬УР2ёцхҘ»щЈ¬хҘ»щЛ®ҪвІъЙъ2ёц·ЦЧУөДC2H5OHәН2ёц-COOHЈ¬HClЎў·УфЗ»щЎў-COOH¶јҝЙТФУлNaOH·ўЙъ·ҙУҰЈ¬ЛщТФ1 mol JФЪЗвСх»ҜДЖИЬТәЦРЛ®ҪвЧо¶аПыәД4 molNaOHЈ»
Ј¬ФЪJЦРә¬УР1ёцClФӯЧУБ¬ҪУФЪұҪ»·ЙПЈ¬Л®ҪвІъЙъHClәН·УфЗ»щЈ»ә¬УР2ёцхҘ»щЈ¬хҘ»щЛ®ҪвІъЙъ2ёц·ЦЧУөДC2H5OHәН2ёц-COOHЈ¬HClЎў·УфЗ»щЎў-COOH¶јҝЙТФУлNaOH·ўЙъ·ҙУҰЈ¬ЛщТФ1 mol JФЪЗвСх»ҜДЖИЬТәЦРЛ®ҪвЧо¶аПыәД4 molNaOHЈ»
(4)HҪб№№јтКҪКЗЈәC2H5OOC-COOC2H5Ј¬·ЦЧУКҪКЗC6H10O4Ј¬ЖдН¬·ЦТм№№МеВъЧгПВБРМхјюўЩЦ»УРБҪЦЦә¬Сх№ЩДЬНЕЈ»ўЪДЬ·ўЙъТшҫө·ҙУҰЛөГчә¬УРИ©»щЈ»ўЫ1 molёГОпЦКУлЧгБҝөДNa·ҙУҰЙъіЙ0.5 mol H2Ј¬ҪбәП·ЦЧУЦРә¬УРөДOФӯЧУКэДҝЛөГчЦ»ә¬УР1ёц-COOHЈ¬БнТ»ЦЦОӘјЧЛбРОіЙөДхҘ»щHCOO-Ј¬ФтҝЙДЬҪб№№ІЙУГ¶ЁТ»ТЖ¶ю·ЁЈ¬№М¶ЁхҘ»щHCOO-Ј¬ТЖ¶Ҝ-COOHөДО»ЦГЈ¬МјБҙҪб№№![]() өДфИ»щҝЙДЬУР
өДфИ»щҝЙДЬУР![]() №І4ЦЦҪб№№Ј»МјБҙҪб№№
№І4ЦЦҪб№№Ј»МјБҙҪб№№![]() өДфИ»щҝЙДЬУР
өДфИ»щҝЙДЬУР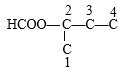 4ЦЦҪб№№Ј»МјБҙҪб№№
4ЦЦҪб№№Ј»МјБҙҪб№№![]() өДфИ»щҝЙДЬУР
өДфИ»щҝЙДЬУР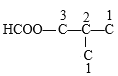 3ЦЦҪб№№Ј»МјБҙҪб№№ОӘ
3ЦЦҪб№№Ј»МјБҙҪб№№ОӘ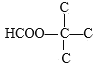 өДфИ»щҝЙДЬО»ЦГЦ»УР
өДфИ»щҝЙДЬО»ЦГЦ»УР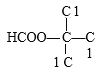 1ЦЦҪб№№Ј¬ТтҙЛ·ыәПТӘЗуөДН¬·ЦТм№№МеөДЦЦАаКэДҝОӘ4+4+3+1=12ЦЦЈ»ЖдЦРәЛҙЕ№ІХсЗвЖЧ·еГж»эұИОӘ1Јә1Јә2Јә6өДҪб№№јтКҪОӘ
1ЦЦҪб№№Ј¬ТтҙЛ·ыәПТӘЗуөДН¬·ЦТм№№МеөДЦЦАаКэДҝОӘ4+4+3+1=12ЦЦЈ»ЖдЦРәЛҙЕ№ІХсЗвЖЧ·еГж»эұИОӘ1Јә1Јә2Јә6өДҪб№№јтКҪОӘ![]() Ўў
Ўў![]() Ј»
Ј»
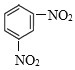
(5)CH3-CH=CH-CH3УлдеЛ®·ўЙъјУіЙ·ҙУҰІъЙъCH3CHBr-CHBrCH3Ј¬И»әуУлNaOHЛ®ИЬТә№ІИИ·ўЙъИЎҙъ·ҙУҰІъЙъ![]() Ј¬
Ј¬![]() ·ўЙъҙЯ»ҜСх»ҜІъЙъQКЗ
·ўЙъҙЯ»ҜСх»ҜІъЙъQКЗ![]() Ј»
Ј»![]() УлЕЁПхЛбЎўЕЁБтЛб»мәПјУИИ·ўЙъПх»Ҝ·ҙУҰІъЙъPКЗ
УлЕЁПхЛбЎўЕЁБтЛб»мәПјУИИ·ўЙъПх»Ҝ·ҙУҰІъЙъPКЗ Ј¬PУлFeЎўHCl·ўЙъ»№Фӯ·ҙУҰІъЙъ
Ј¬PУлFeЎўHCl·ўЙъ»№Фӯ·ҙУҰІъЙъ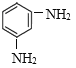 Ј¬
Ј¬ Ул
Ул![]() ФЪHAcҙжФЪМхјюПВЈ¬јУИИ40ЎӘ50Ўж·ҙУҰІъЙъ
ФЪHAcҙжФЪМхјюПВЈ¬јУИИ40ЎӘ50Ўж·ҙУҰІъЙъ![]() әНH2OЈ¬№КPКЗ
әНH2OЈ¬№КPКЗ Ј¬QКЗ
Ј¬QКЗ![]() ЎЈ
ЎЈ


 І№ідП°МвҪӯЛХПөБРҙр°ё
І№ідП°МвҪӯЛХПөБРҙр°ё С§Б·ҝміөөАҝЪЛгРДЛгЛЩЛгМмМмБ·ПөБРҙр°ё
С§Б·ҝміөөАҝЪЛгРДЛгЛЩЛгМмМмБ·ПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПт5 mL NaClИЬТәЦРөОИлТ»өОAgNO3ИЬТәЈ¬іцПЦ°ЧЙ«іБөнЈ¬јМРшөОјУТ»өОKIИЬТәІўХсөҙЈ¬іБөнұдОӘ»ЖЙ«Ј¬ФЩөОИлТ»өОNa2SИЬТәІўХсөҙЈ¬іБөнУЦұдіЙәЪЙ«Ј¬ёщҫЭЙПКцұд»Ҝ№эіМЈ¬·ЦОцҙЛИэЦЦіБөнОпөДИЬҪв¶И№ШПөОӘ
A. AgClЈҪAgIЈҪAg2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝұҪөДҪб№№јтКҪҝЙУГ![]() АҙұнКҫЈ¬ПВБР№ШУЪұҪөДРрКцЦРХэИ·өДКЗ
АҙұнКҫЈ¬ПВБР№ШУЪұҪөДРрКцЦРХэИ·өДКЗ
A. ұҪЦчТӘКЗТФКҜУНОӘФӯБП¶ш»сөГөДТ»ЦЦЦШТӘ»Ҝ№ӨФӯБП
B. ұҪЦРә¬УРМјМјЛ«јьЈ¬ЛщТФұҪКфУЪП©Мю
C. ұҪ·ЦЧУЦР6ёцМјМј»ҜС§јьНкИ«ПаН¬
D. ұҪҝЙТФУлдеЛ®ЎўёЯГМЛбјШИЬТә·ҙУҰ¶шК№ЛьГЗНКЙ«
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПгАјЛШКЗЦШТӘөДПгБПЦ®Т»Ј¬ЛьҝЙУЙ¶ЎПг·Уҫӯ¶аІҪ·ҙУҰәПіЙЎЈ
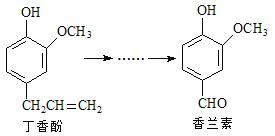
УР№ШЙПКцБҪЦЦ»ҜәПОпөДЛө·ЁХэИ·өДКЗ
A. іЈОВПВЈ¬1mol¶ЎПг·УЦ»ДЬУл1molBr2·ҙУҰ
B. ¶ЎПг·УІ»ДЬК№FeCl3ИЬТә·ўЙъПФЙ«·ҙУҰ
C. 1molПгАјЛШЧо¶аДЬУл3molЗвЖш·ўЙъјУіЙ·ҙУҰ
D. ПгАјЛШ·ЦЧУЦРЦБЙЩУР12ёцФӯЧУ№ІЖҪГж
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝөӘ»ҜоС(Ti3N4)ОӘҪр»ЖЙ«ҫ§МеЈ¬УЙУЪҫЯУРБоИЛВъТвөД·ВҪрР§№ыЈ¬ФҪАҙФҪ¶аөШіЙОӘ»ЖҪрөДҙъМжЖ·ЎЈТФTiCl4ОӘФӯБПЈ¬ҫӯ№эТ»ПөБР·ҙУҰҝЙТФЦЖөГTi3N4әНДЙГЧTiO2(ИзНј1)ЎЈ
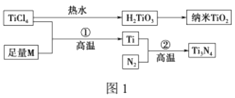
НјЦРөДMКЗ¶МЦЬЖЪҪрКфФӘЛШЈ¬MөДІҝ·ЦөзАлДЬИзұнЈә
I1 | I2 | I3 | I4 | I5 | |
өзАлДЬ/(kJ/mol) | 738 | 1451 | 7733 | 10540 | 13630 |
Зл»ШҙрПВБРОКМвЈә
(1)TiөД»щМ¬ФӯЧУНвО§өзЧУЕЕІјКҪОӘ________________ЎЈ
(2)MКЗ________(МоФӘЛШ·ыәЕ)Ј¬ёГҪрКфҫ§МеөД¶С»эДЈРНОӘБщ·ҪЧоГЬ¶С»эЈ¬ЕдО»КэОӘ____ЎЈ
(3)ДЙГЧTiO2КЗТ»ЦЦУҰУГ№г·әөДҙЯ»ҜјБЈ¬ДЙГЧTiO2ҙЯ»ҜөДТ»ёцКөАэИзНј2ЛщКҫЎЈ»ҜәПОпјЧөД·ЦЧУЦРІЙИЎsp2·ҪКҪФУ»ҜөДМјФӯЧУУР________ёцЈ¬»ҜәПОпТТЦРІЙИЎsp3·ҪКҪФУ»ҜөДФӯЧУ3¶ФУҰөДФӘЛШөДөзёәРФУЙҙуөҪРЎөДЛіРтОӘ________________ЎЈ
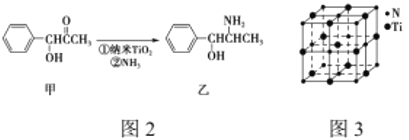
(4)УРТ»ЦЦөӘ»ҜоСҫ§МеөДҫ§°ыУлNaClҫ§°ыПаЛЖЈ¬ИзНј3ЛщКҫЈ¬ёГҫ§°ыЦРNЎўTiЦ®јдөДЧоҪьҫаАлОӘa pmЈ¬ФтёГөӘ»ҜоСөДГЬ¶ИОӘ________________g/cm3 (NAОӘ°ў·ьјУөВВЮіЈКэөДЦөЈ¬Ц»БРјЖЛгКҪ)ЎЈёГҫ§МеЦРУлөӘФӯЧУҫаАлПаөИЗТЧоҪьөДөӘФӯЧУУР________ёцЎЈ
(5)ҝЖС§јТНЁ№эX-ЙдПЯМҪГчKClЎўMgOЎўCaOЎўTiNөДҫ§МеУлNaClөДҫ§МеҪб№№ПаЛЖЎЈЗТЦӘИэЦЦАлЧУҫ§МеөДҫ§ёсДЬКэҫЭЈә
АлЧУҫ§Ме | NaCl | KCl | CaO |
ҫ§ёсДЬ/(kJ/mol) | 786 | 715 | 3401 |
KClЎўCaOЎўTiNИэЦЦАлЧУҫ§МеИЫөгУЙёЯөҪөНөДЛіРтОӘ__________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝWЎўXЎўYЎўZ ЛДЦЦ¶МЦЬЖЪФӘЛШФЪФӘЛШЦЬЖЪұнЦРөДПа¶ФО»ЦГИзНјЛщКҫЈ¬Z өДФӯЧУРтКэКЗ X өД 2ұ¶ЎЈПВБРЛө·ЁІ»ХэИ·өДКЗ
![]()
A.X ФӘЛШРОіЙөДЗв»ҜОп·РөгұИ W өДёЯ
B.ЛДЦЦФӘЛШФӯЧУ°лҫ¶ҙУҙуРЎөДЕЕБРЛіРт YЈҫZЈҫXЈҫW
C.X өДТ»ЦЦЗв»ҜОпәН XЎўZ РОіЙөДТ»ЦЦ»ҜәПОпҫЯУРПаН¬ФӯАнөДЖҜ°ЧЧчУГ
D.Y өДСх»ҜОпДЬУл W өДЗв»ҜОп·ҙУҰ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝјоРФРҝГМөзіШұИЖХНЁөДРҝГМёЙөзіШРФДЬУЕФҪЈ¬ДЬМṩҪПҙуөДөзБчІўБ¬Рш·ЕөзЈ¬Жд№№ФмИзНјЛщКҫЎЈөзіШ·ҙУҰ·ҪіМКҪОӘ 2MnO2+Zn+2H2O=2MnO (OH)+Zn (OH)2ЎЈПВБРЛө·ЁІ»ХэИ·өДКЗ
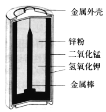
A.өзіШК№УГ№эіМЦРЈ¬өзҪвЦКөДјоРФФцЗҝ
B.Рҝ·ЫКЗёГөзіШөДёәј«
C.MnO2 өзј«өДөзј«·ҙУҰКҪЈәMnO2+eЎҘЈ«H2O=MnO(OH)+OHЎҘ
D.өұөзіШК№УГКұЈ¬OHЎҘТЖПтөзіШөДХэј«
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ5©Ғ¶юјЧСх»щұҪ·УКЗЦШТӘөДУР»ъәПіЙЦРјдМеЈ¬ҝЙУГУЪМмИ»ОпЦК°ЧДыГКЛШөДәПіЙЈ¬Т»ЦЦТФјдұҪИэ·УОӘФӯБПөДәПіЙ·ҙУҰИзПВЈә

јЧҙјЎўТТГСәН3Ј¬5©Ғ¶юјЧСх»щұҪ·УөДІҝ·ЦОпАнРФЦКјыПВұнЈә

ЈЁ1Ј©·ҙУҰҪбКшәуЈ¬ПИ·ЦАліцјЧҙјЈ¬ФЩјУИлТТГСҪшРРЭНИЎЈ¬ўЩ·ЦАліцјЧҙјөДІЩЧчКЗөД______Ј»ўЪЭНИЎУГөҪөД·ЦТәВ©¶·К№УГЗ°Ри__________________ІўПҙҫ»Ј¬·ЦТәКұУР»ъІгФЪ·ЦТәВ©¶·өД________МоЈЁЎ°ЙПЎұ»тЎ°ПВЎұЈ©ІгЈ»
ЈЁ2Ј©·ЦАлөГөҪөДУР»ъІгТАҙОУГұҘәНNaHCO3ИЬТәЎўұҘәНКіСОЛ®ЎўЙЩБҝХфБуЛ®ҪшРРПҙөУЈ®УГұҘәНNaHCO3ИЬТәПҙөУөДДҝөДКЗ__Ј¬УГұҘәНКіСОЛ®ПҙөУөДДҝөДКЗ______Ј»
ЈЁ3Ј©ПҙөУНкіЙәуЈ¬НЁ№эТФПВІЩЧч·ЦАлЎўМбҙҝІъОпЈ¬ХэИ·өДІЩЧчЛіРтКЗ__ЈЁМоЧЦДёЈ©Ј»
aЈ®ХфБуіэИҘТТГС bЈ®ЦШҪбҫ§ cЈ®№эВЛіэИҘёЙФпјБ dЈ®јУИлОЮЛ®CaCl2ёЙФп
ЈЁ4Ј©№МТә·ЦАліЈІЙУГјхС№№эВЛЈ®ОӘБЛ·АЦ№ө№ОьЈ¬јхС№№эВЛНкіЙәуУҰПИ________________Ј¬ФЩ______ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУГ50mL0.50mol/LСОЛбУл50mL0.55mol/LNaOHИЬТәФЪИзНјЛщКҫөДЧ°ЦГЦРҪшРРЦРәН·ҙУҰЎЈНЁ№эІв¶Ё·ҙУҰ№эіМЦРЛщ·ЕіцөДИИБҝҝЙјЖЛгЦРәНИИЎЈ»ШҙрПВБРОКМвЈә
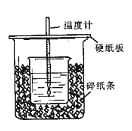
ЈЁ1Ј©ҙУКөСйЧ°ЦГЙПҝҙЈ¬НјЦРЙРИұЙЩөДТ»ЦЦІЈБ§ТЗЖчКЗ ЎЈ
ЈЁ2Ј©ЙХұӯјдМоВъЛйЦҪМхөДЧчУГКЗ ЎЈ
ЈЁ3Ј©ҙуЙХұӯЙПИзІ»ёЗУІЦҪ°еЈ¬ЗуөГөДЦРәНИИКэЦө (МоЎ°Ж«ҙуЎўЖ«РЎЎўОЮУ°ПмЎұ)
ЈЁ4Ј©Из№ыУГ60mL0.50mol/LСОЛбУл50mL0.55mol/LNaOHИЬТәҪшРР·ҙУҰЈ¬УлЙПКцКөСйПаұИЈ¬Лщ·ЕіцөДИИБҝ (МоЎ°ПаөИЎўІ»ПаөИЎұ)Ј¬ЛщЗуЦРәНИИ (МоЎ°ПаөИЎўІ»ПаөИЎұ)Ј¬јтКцАнУЙ
ЈЁ5Ј©УГПаН¬ЕЁ¶ИәНМе»эөД°ұЛ®(NH3ЎӨH2O)ҙъМжNaOHИЬТәҪшРРЙПКцКөСйЈ¬ІвөГөДЦРәНИИөДКэЦө»б Ј»ЈЁМоЎ°Ж«ҙуЎұЎўЎ°Ж«РЎЎұЎўЎ°ОЮУ°ПмЎұЈ©ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com