
【题目】氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1)。
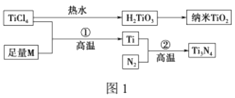
图中的M是短周期金属元素,M的部分电离能如表:
I1 | I2 | I3 | I4 | I5 | |
电离能/(kJ/mol) | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为________________。
(2)M是________(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为____。
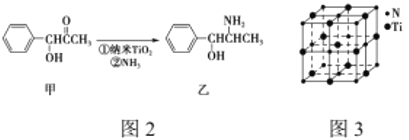
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中采取sp2方式杂化的碳原子有________个,化合物乙中采取sp3方式杂化的原子3对应的元素的电负性由大到小的顺序为________________。
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为________________g/cm3 (NA为阿伏加德罗常数的值,只列计算式)。该晶体中与氮原子距离相等且最近的氮原子有________个。
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据:
离子晶体 | NaCl | KCl | CaO |
晶格能/(kJ/mol) | 786 | 715 | 3401 |
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为__________________。
【答案】3d24s2 Mg 12 7 O>N>C 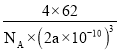 12 TiN>CaO>KCl
12 TiN>CaO>KCl
【解析】
(1)Ti原子核外电子数为22,根据能量最低原理书写;
(2)M是短周期金属元素,M的第三电离能剧增,处于ⅡA族,能与TiCl4反应置换出Ti,则M为Mg,Mg晶体属于六方最密堆积,配位数为12;
(3)采取sp2杂化的碳原子价层电子对数是3,采取sp3杂化的原子价层电子对数是4,乙中采取sp3杂化的原子有C、N、O,同一周期元素中,元素的电负性随着原子序数的增大;
(4)根据均摊法计算晶胞中Ti、N原子数目,进而计算晶胞质量,根据ρ=![]() 计算晶胞密度;以晶胞顶点N原子研究,与之距离相等且最近的N原子处于面心位置;
计算晶胞密度;以晶胞顶点N原子研究,与之距离相等且最近的N原子处于面心位置;
(5)由表中数据可知,离子半径越小晶格能越大,离子带电荷越大,晶格能越大,晶格能大,对应的离子晶体的熔点就越高。
(1)Ti为22号元素,原子核外电子排布为1s22s22p63s23p63d24s2,因此外围电子排布式为3d24s2;
(2)M是短周期金属元素,M的第三电离能剧增,处于ⅡA族,能与TiCl4反应置换出Ti,则M为Mg,Mg晶体属于六方最密堆积,配位数为12;
(3)化合物甲的分子中采取sp2杂化的碳原子为苯环上的六个、羰基中的一个,共7个该C原子;
采取sp3杂化的原子价层电子对数是4,乙中采取sp3杂化的原子有C、N、O,同一周期元素中,元素电负性随着原子序数依次增加电负性逐渐增大,所以它们的电负性关系为:O>N>C;
(4)根据均摊法,可知该晶胞中N原子个数为:6×![]() +8×
+8×![]() =4,该晶胞中Ti原子个数为:1+12×
=4,该晶胞中Ti原子个数为:1+12×![]() =4,所以晶胞的质量m=4×
=4,所以晶胞的质量m=4×![]() g,而晶胞的体积V=(2a×10-10)3cm3,所以晶体的密度ρ=
g,而晶胞的体积V=(2a×10-10)3cm3,所以晶体的密度ρ=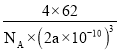 g/cm3;以晶胞顶点N原子研究,与之距离相等且最近的N原子处于面心位置,每个顶点为8个晶胞共用。每个面为2个晶胞共用,故与之距离相等且最近的N原子为
g/cm3;以晶胞顶点N原子研究,与之距离相等且最近的N原子处于面心位置,每个顶点为8个晶胞共用。每个面为2个晶胞共用,故与之距离相等且最近的N原子为![]() =12;
=12;
(5)离子晶体中,离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,则有TiN>CaO,由表中数据可知CaO>KCl,则三种晶体的晶格能由大到小的顺序为:TiN>CaO>KCl,所以KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为TiN>CaO>KCl。


科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都一定正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 某钾盐溶于盐酸后,产生无色无味气体,将其通入澄清石灰水 | 有白色沉淀出现 | 该钾盐是 |
B | 将少量的溴水分别滴入 | 下层分别呈无色和紫红色 | 还原性: |
C | 将充满 | 红棕色变深 | 反应 |
D | 将 | 溶液变浑浊,继续通入该气体,浑浊消失 | 该溶液是 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(g)+nB(g)=eC(g)+fD(s) △H。若按反应物的化学计量数比投料,在一定条件下进行反应,该反应达到平衡时C的气体体积分数与温度、压强的关系如图所示。下列叙述正确的是
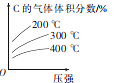
A.该反应的△H >0
B.该化学方程式中m+n>e+f
C.加入催化剂可加快正反应速率,逆反应速率不变
D.往平衡后的恒压容器中再充入一定量C,达到新平衡时,C的浓度与原平衡时的相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,且Y、Q形成一种共价化合物,X的最高价氧化物对应的水化物可与Y单质反应产生常见的还原性气体单质E。下列说法正确的是
A.X、Y、Q对应简单离子的半径逐渐减小
B.工业上可用电解X、Q元素组成的化合物的饱和溶液制备Q单质
C.Y、Q形成的化合物是非电解质
D.工业用W与Z的最高价氧化物反应制取Z单质,同时得到W的最高价氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某石油化工产品X的转化关系如图,下列判断不正确的是( )
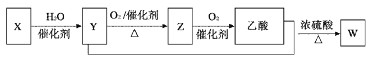
A. X可以发生加聚反应B. Y能与钠反应产生氢气
C. Z与CH3OCH3互为同分异构体D. W的结构简式为CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期科研人员发现磷酸氯喹等药物对新型冠状病毒肺炎患者疗效显著。磷酸氯喹中间体合成路线如下:
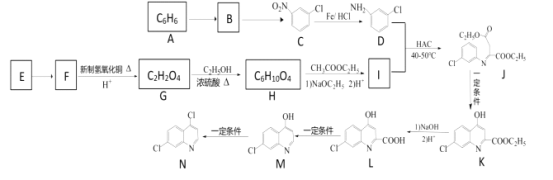
已知:Ⅰ.卤原子为苯环的邻对位定位基,它会使第二个取代基主要进入它的邻对位;硝基为苯环的间位定位基,它会使第二个取代基主要进入它的间位。
Ⅱ. E为汽车防冻液的主要成分。
Ⅲ. 2CH3COOC2H5![]() CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH
请回答下列问题
(1)写出B的名称__________,C→D的反应类型为_____________ ;
(2)写出E生成F的化学方程式___________________________。
写出H生成I的化学方程式__________________。
(3)1 mol J在氢氧化钠溶液中水解最多消耗________mol NaOH。
(4)H有多种同分异构体,其满足下列条件的有_________种(不考虑手性异构),其中核磁共振氢谱峰面积比为1:1:2:6的结构简式为___________。
①只有两种含氧官能团
②能发生银镜反应
③1 mol 该物质与足量的Na反应生成0.5 mol H2
(5)以硝基苯和2-丁烯为原料可制备化合物,![]() 合成路线如图:
合成路线如图:
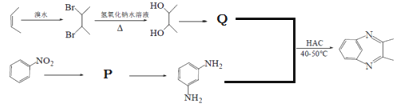
写出P、Q结构简式:P_______,Q________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价电子排布式为3s23p4的粒子描述正确的是( )
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.它可与H2生成液态化合物
D.其电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化铬的化学式为 CrO5,从其结构发现含有 2 个过氧键,结构如图, 下列说法不正确的是

A.CrO5可能具有强氧化性
B.CrO5 溶于水可能放出氧气
C.CrO5 稳定性较低,易分解
D.CrO5 中 Cr 的化合价为+10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种浓差电池如图所示,阴、阳离子交换膜交替放置,中间的间隔交替充以河水和海水,选择性透过Cl和Na+,在两电极板形成电势差,进而在外部产生电流。下列关于该电池的说法正确的是( )

A.a电极为电池的正极,电极反应为2H++2e═H2↑
B.C为阴离子交换膜,A为阳离子交换膜
C.负极隔室的电中性溶液通过阳极表面的还原作用维持
D.该电池的缺点是离子交换膜价格昂贵,优点是电极产物有经济价值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com