
【题目】过氧化铬的化学式为 CrO5,从其结构发现含有 2 个过氧键,结构如图, 下列说法不正确的是

A.CrO5可能具有强氧化性
B.CrO5 溶于水可能放出氧气
C.CrO5 稳定性较低,易分解
D.CrO5 中 Cr 的化合价为+10
科目:高中化学 来源: 题型:
【题目】钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)Mo可被发烟硝酸及氢氟酸氧化为MoO2F2和MoOF4(少量),硝酸本身被还原为NO2,则该反应中氧化剂与还原剂的物质的量之比为_________。
(2)已知:2Mo(s)+3O2(g)=2MoO3(s) △H1;
2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H2;
MoS2(s)+2 O2(g)=Mo(s)+2SO2(g) △H3
则△H3=_________(用含△H1、△H2的代数式表示)
(3)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-
①辉钼矿应放入电解槽的_________(填“阴极区”或“阳极区”)。
②阴极的电极反应式为___________________________。
(4)碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2(s)+4H2(g)+2Na2CO3(s) ![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
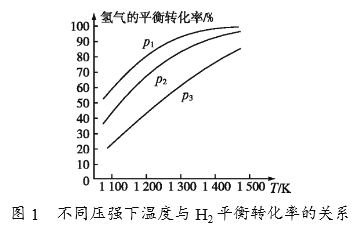
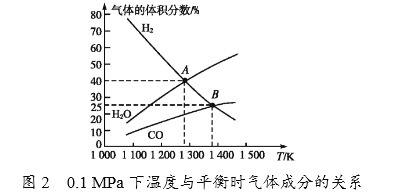
①由图1可知,该反应△H______(填“>”或“<”)0,p1、p2、p3由大到小的顺序为_______________________。
②由图2可知,A点时H2的平衡转化率为____________。
③B点对应的平衡常数K=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(MPa)2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1)。
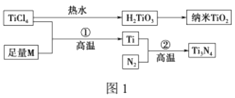
图中的M是短周期金属元素,M的部分电离能如表:
I1 | I2 | I3 | I4 | I5 | |
电离能/(kJ/mol) | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为________________。
(2)M是________(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为____。
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中采取sp2方式杂化的碳原子有________个,化合物乙中采取sp3方式杂化的原子3对应的元素的电负性由大到小的顺序为________________。
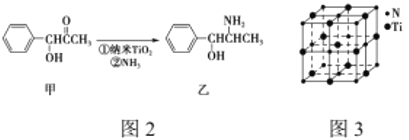
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为________________g/cm3 (NA为阿伏加德罗常数的值,只列计算式)。该晶体中与氮原子距离相等且最近的氮原子有________个。
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据:
离子晶体 | NaCl | KCl | CaO |
晶格能/(kJ/mol) | 786 | 715 | 3401 |
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池比普通的锌锰干电池性能优越,能提供较大的电流并连续放电,其构造如图所示。电池反应方程式为 2MnO2+Zn+2H2O=2MnO (OH)+Zn (OH)2。下列说法不正确的是
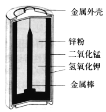
A.电池使用过程中,电解质的碱性增强
B.锌粉是该电池的负极
C.MnO2 电极的电极反应式:MnO2+eˉ+H2O=MnO(OH)+OHˉ
D.当电池使用时,OHˉ移向电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B都是芳香族化合物,![]() 水解得到
水解得到![]() 和1mol醋酸。A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O。且B分子中碳和氢元素总的质量分数为65.2%。A溶液具有酸性,不能使氯化铁溶液显色。
和1mol醋酸。A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O。且B分子中碳和氢元素总的质量分数为65.2%。A溶液具有酸性,不能使氯化铁溶液显色。
(1)A、B相对分子质量之差为____________________。
(2)1个B中应该有____________________个氧原子。
(3)A的分子式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
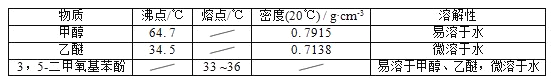
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瘦肉精,学名盐酸克伦特罗,该药物既不是兽药,也不是饲料添加剂,而是肾上腺类神经兴奋剂,可以增加动物的瘦肉量.减少饲料使用.使肉品提早上市,降低成本,但对人体会产生副作用,盐酸克伦特罗分子结构简式如下图。下列说法不正确的是( )
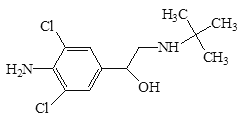
A.瘦肉精的分子式是C11H18ON2Cl2
B.物质能发生取代反应、氧化反应、加成反应和水解反应
C.1mol盐酸克伦特罗最多能与4molNaOH反应
D.盐酸克伦特罗分子中至少有7个碳原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是目前最有效工业固氮的方法,解决数亿人口生存问题。回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

由图可知合成氨反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的H=___ kJ·mol-1。该历程中反应速率最慢的步骤的化学方程式为___。
NH3(g)的H=___ kJ·mol-1。该历程中反应速率最慢的步骤的化学方程式为___。
(2)工业合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:

①500℃时,反应平衡常数Kp(30MPa)___ Kp(100MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为___(保留2位有效数字),Kp=___(MPa)-2(列出计算式)。
(3)科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观示意如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。

①阴极区生成NH3的电极方程式为___。
②下列说法正确的是___(填标号)。
A.三氟甲磺酸锂的作用是增强导电性
B.该装置用金(Au)作催化剂目的是降低N2的键能
C.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于水的电离平衡H2O![]() H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.加热,Kw增大,pH不变
B.向水中加入少量盐酸,c(H+)增大,Kw不变
C.向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
D.向水中加入NaOH固体,平衡逆向移动,c(OH-)降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com