
【题目】关于水的电离平衡H2O![]() H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.加热,Kw增大,pH不变
B.向水中加入少量盐酸,c(H+)增大,Kw不变
C.向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
D.向水中加入NaOH固体,平衡逆向移动,c(OH-)降低
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】过氧化铬的化学式为 CrO5,从其结构发现含有 2 个过氧键,结构如图, 下列说法不正确的是

A.CrO5可能具有强氧化性
B.CrO5 溶于水可能放出氧气
C.CrO5 稳定性较低,易分解
D.CrO5 中 Cr 的化合价为+10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种浓差电池如图所示,阴、阳离子交换膜交替放置,中间的间隔交替充以河水和海水,选择性透过Cl和Na+,在两电极板形成电势差,进而在外部产生电流。下列关于该电池的说法正确的是( )

A.a电极为电池的正极,电极反应为2H++2e═H2↑
B.C为阴离子交换膜,A为阳离子交换膜
C.负极隔室的电中性溶液通过阳极表面的还原作用维持
D.该电池的缺点是离子交换膜价格昂贵,优点是电极产物有经济价值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些稠环环芳烃的结构简式如图,下列说法正确的是( )
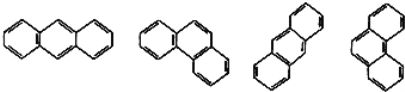
A. 这些结构简式表示的化合物有3种
B. 它们的分子式不相同
C. 所有原子均在同一平面
D. 它们与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以方铅矿(PbS)为原料制备铅蓄电池的电极材料的工艺流程如图所示: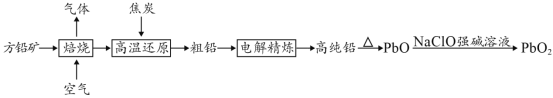
请回答下列问题:
(1)“焙烧”生成的气体直接排放可能造成的环境问题是____________,“焙烧”前须将方铅矿研磨粉粹的目的是________________________________。
(2)电解时,如c(Pb2+)远大于c(H+),则Pb2+优先于H+放电,工业上应用此原理可对铅进行电解精炼。“粗铅”的杂质主要有锌、铁、铜、银等,则阳极泥的主要成分为_________。
(3)写出制备PbO2的离子方程式________________________。
(4)已知部分含铅化合物的Ksp如下表所示:
物质 | PbCl2 | PbS |
Ksp | 1.2×10-5 | 9.0×10-29 |
①铅与稀盐酸反应产生少量气泡后反应终止,原因是_____________________。
②Pb(NO3)2是强酸弱碱盐,氢硫酸是弱酸[Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15],已知K>105时可以认为反应基本完全,通过计算判断向Pb(NO3)2溶液中通入H2S气体能否形成PbS沉淀___________________。(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2 是一种黄绿色易溶于水的气体,具有强氧化性, 回答下列问题:
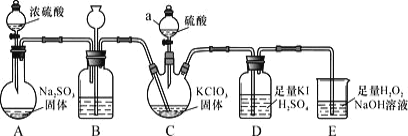
(1)ClO2 的制备及性质探究(如图所示)
①仪器 C 的名称为_________,装置 B 的作用是________。
②装置C 用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为_____,装置 D 中滴有几滴淀粉溶液,其作用是_______。
③装置E 用于吸收尾气,反应生成NaClO2,则该反应中氧化剂与还原剂的物质的量之比为___,氧化产物是___。
(2)粗略测定生成 ClO2 的量实验步骤如下:
a、取下装置 D,将其中的溶液转入 250mL 容量瓶,用蒸馏水洗涤 D 瓶 2~3 次,并将洗涤液一并转移到容量瓶中,再用蒸馏水稀释至刻度。
b、从容量瓶中取出 25.00mL 溶液于锥形瓶中,用 0.1000mol/L 硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去 24.00 mL 硫代硫酸钠溶液。
①滴定至终点的现象是___。
②进入装置 D 中的 ClO2 质量为___,与 C 中 ClO2 的理论产量相比,测定值偏低, 可能的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数![]() (X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是
(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是![]()
![]()
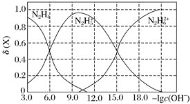
A.Kb1(N2H4)=10-6
B.反应![]() 的pK=9.0(已知:Pk=-lgK)
的pK=9.0(已知:Pk=-lgK)
C.N2H5Cl溶液中c(H+)>c(OH-)
D.N2H5Cl溶液中存在c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不能正确表示体系颜色变化的是
A.向AgCl悬浊液中加入Na2S溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)
Ag2S(s)+2Cl-(aq)
B.向酸性KMnO4溶液中加入NaHSO3固体,溶液紫色褪去:2MnO4-+5SO32-+6H+===2Mn2++5SO42-+3H2O
C.向橙色K2Cr2O7溶液中加入NaOH溶液,溶液变黄色:Cr2O72-+2OH-![]() 2CrO42-+H2O
2CrO42-+H2O
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。下图为一套浓差电池和电解质溶液再生的配套装置示意图,闭合开关K之前,两个Cu电极的质量相等。下列有关这套装置的说法中错误的是

A. 循环物质E为水
B. 乙池中Cu电极为阴极,发生还原反应
C. 甲池中的电极反应式为Cu2++2e-=Cu
D. 若外电路中通过1mol电子,两电极的质量差为64g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com