
【题目】下列离子方程式不能正确表示体系颜色变化的是
A.向AgCl悬浊液中加入Na2S溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)
Ag2S(s)+2Cl-(aq)
B.向酸性KMnO4溶液中加入NaHSO3固体,溶液紫色褪去:2MnO4-+5SO32-+6H+===2Mn2++5SO42-+3H2O
C.向橙色K2Cr2O7溶液中加入NaOH溶液,溶液变黄色:Cr2O72-+2OH-![]() 2CrO42-+H2O
2CrO42-+H2O
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O
【答案】B
【解析】
A.向AgCl悬浊液中滴加Na2S溶液时,由于Ag2S比AgCl更难溶,发生沉淀的转化,反应的离子反应为:2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq),选项A正确;
Ag2S(s)+2Cl-(aq),选项A正确;
B. 向酸性KMnO4溶液中加入NaHSO3固体,HSO3-将MnO4-还原而使溶液紫色褪去,反应的离子方程式为2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O,选项B错误;
C.向橙色K2Cr2O7溶液中加入一定浓度的NaOH溶液后,发生Cr2O72-+2OH-![]() 2CrO42-+H2O,平衡向正反应方向移动,溶液变为黄色,选项C正确;
2CrO42-+H2O,平衡向正反应方向移动,溶液变为黄色,选项C正确;
D. 向稀硝酸中加入铜粉,铜与稀硝酸反应生成硝酸铜,溶液变蓝色,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,选项D正确;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】合成氨是目前最有效工业固氮的方法,解决数亿人口生存问题。回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

由图可知合成氨反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的H=___ kJ·mol-1。该历程中反应速率最慢的步骤的化学方程式为___。
NH3(g)的H=___ kJ·mol-1。该历程中反应速率最慢的步骤的化学方程式为___。
(2)工业合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:

①500℃时,反应平衡常数Kp(30MPa)___ Kp(100MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为___(保留2位有效数字),Kp=___(MPa)-2(列出计算式)。
(3)科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观示意如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。

①阴极区生成NH3的电极方程式为___。
②下列说法正确的是___(填标号)。
A.三氟甲磺酸锂的作用是增强导电性
B.该装置用金(Au)作催化剂目的是降低N2的键能
C.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于水的电离平衡H2O![]() H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.加热,Kw增大,pH不变
B.向水中加入少量盐酸,c(H+)增大,Kw不变
C.向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
D.向水中加入NaOH固体,平衡逆向移动,c(OH-)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯、苯乙烯均是重要的化工原料。
![]() 工业上可用乙苯催化脱氢方法制备苯乙烯
工业上可用乙苯催化脱氢方法制备苯乙烯
①已知部分化学键的键能如下:
化学键 | C-H | C-C |
| H-H |
键能/(kJ/mol) | 412 | 348 | 612 | 436 |
则![]() +H2(g)的
+H2(g)的![]() ________kJ/mol。
________kJ/mol。
②实际生产中常在恒压条件下掺入高温水蒸气作为反应体系的稀释剂![]() 水蒸气不参加反应
水蒸气不参加反应![]() 。在一定压强、900 K的条件下,乙苯的平衡转化率随着
。在一定压强、900 K的条件下,乙苯的平衡转化率随着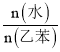 的增大而________
的增大而________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() 。随着反应的进行,少量积碳会使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是____________
。随着反应的进行,少量积碳会使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是____________![]() 用化学方程式表示
用化学方程式表示![]() 。
。
![]() 苯乙烯可由乙苯和
苯乙烯可由乙苯和![]() 催化脱氢制得。其反应历程如下:
催化脱氢制得。其反应历程如下:
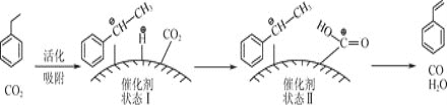
乙苯平衡转化率与![]() 的关系如图所示,当P(CO2)< 15 kPa时,乙苯平衡转化率随着
的关系如图所示,当P(CO2)< 15 kPa时,乙苯平衡转化率随着![]() 增大而增大,其原因是__________,当P(CO2)> 15 kPa时,乙苯平衡转化率随着
增大而增大,其原因是__________,当P(CO2)> 15 kPa时,乙苯平衡转化率随着![]() 增大反而减小,其原因是____________。
增大反而减小,其原因是____________。
![]() 研究表明金属次卟啉二甲酯能够顺利地选择性催化氧化苯乙烯生成苯甲醛,以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为 ________。若该电池消耗标准状况下22.4L的
研究表明金属次卟啉二甲酯能够顺利地选择性催化氧化苯乙烯生成苯甲醛,以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为 ________。若该电池消耗标准状况下22.4L的![]() ,则外电路中理论上转移电子的物质的量为________。
,则外电路中理论上转移电子的物质的量为________。
(4)上海交通大学仇毅翔等研究了不同含金化合物催化乙烯加氢![]() 的反应历程如下图所示:
的反应历程如下图所示:

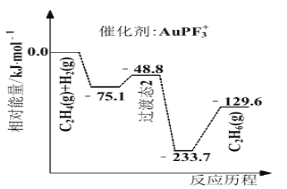
则![]() ____________,催化乙烯加氢效果较好的催化剂是________(选填“
____________,催化乙烯加氢效果较好的催化剂是________(选填“![]() ”或“
”或“![]() ”)。
”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员研制出一种新型储备电源-锂水电池(结构如图,高硅铸铁为惰性辅助电极),使用时加入水即可放电。下列关于该电池工作时的说法正确的是
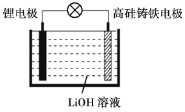
A.高硅铸铁发生氧化反应B.OH-向高硅铸铁电极移动
C.负极的电极反应式为Li-e-=Li+D.电流的方向:锂电极→导线→高硅铸铁电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积的密闭容器中,A和B发生下列反应:A(s)+2B(g)![]() 2C(g) △H>0,在一定条件下达到平衡,若升高温度则达平衡后混合气体的
2C(g) △H>0,在一定条件下达到平衡,若升高温度则达平衡后混合气体的
A.气体的分子数减少B.A的物质的量浓度减小
C.气体的密度减小D.气体的平均相对分子质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期元素Q位于ds区,最外层电子半充满;短周期元素W、X、Y、Z第一电离能与原子序数的关系如下图所示,请回答下列问题(用Q、W、X、Y、Z所对应的元素符号作答):
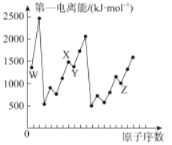
(1)基态Y原子核外共有___种运动状态不相同的电子。若用n表示能层,则与Y元素同族的元素的基态原子的价电子排布式为_________________。
(2)X、W组成的一种二元化合物常用作火箭燃料,该化合物中X原子的杂化方式为___________。该化合物常温下呈液态,其沸点高于Y2沸点的原因为___________。
(3)X2Y曾被用作麻醉剂,根据“等电子体原理”预测X2Y的空间构型为______________。
(4)XW3存在孤电子对,可形成[Q(XW3)4]2+离子,该离子中不存在_____________(填序号)。
A.极性共价键 B.非极性共价键 C.配位键 D.σ键 E.π键
(5)Q与X形成的一种二元化合物的立方晶胞结构如图所示:
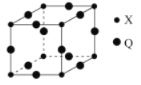
①Q原子周围距其距离最近的Q原子的数目为_______。
②该二元化合物的化学式为___________________。
(6)已知单质Q晶体的堆积方式为面心立方最密堆积,则单质Q晶体的晶胞中原子的空间利用率为_________________(用含π的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,关于下列溶液混合后溶液pH的说法中正确的是( )
A.pH=10与pH=12的NaOH溶液等体积混合,溶液的pH约为11
B.pH=5的盐酸溶液稀释1000倍,溶液的pH=8
C.pH=2的H2SO4与pH=12的NaOH溶液等体积混合,混合液pH=7
D.pH=12的NH3·H2O与pH=2的HCl溶液等体积混合,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
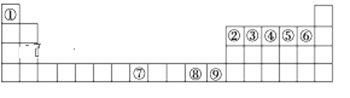
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,元素⑦位于周期表的___区。
(2)写出元素③与元素⑤形成的稳定化合物的结构式___________。
(3)②、⑥两元素形成的化合物的立体构型为_______,其中心原子的杂化轨道类型为______。
(4)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于_____晶体(填晶体类型)。
(5)⑧的二价阳离子与过量的④的简单氢化物的水溶液作用的离子方程式_________。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为____。
(7)将①、⑥形成的化合物溶于水,其中可能存在的氢键表示为_______(写一种即可)。
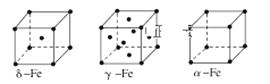
(8)金属⑦有δ、γ、α三种同素异形体,各晶胞如下图,则δ和α中原子的配位数之比为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com