
【题目】研究人员研制出一种新型储备电源-锂水电池(结构如图,高硅铸铁为惰性辅助电极),使用时加入水即可放电。下列关于该电池工作时的说法正确的是
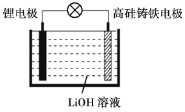
A.高硅铸铁发生氧化反应B.OH-向高硅铸铁电极移动
C.负极的电极反应式为Li-e-=Li+D.电流的方向:锂电极→导线→高硅铸铁电极
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】常温下,HCOOH和CH3COOH的电离常数分别1.80×104和1.75×105。将pH=3,体积均为V0的两种酸溶液分别加水稀释至体积V,pH随lg![]() 的变化如图所示。下列叙述错误的是( )
的变化如图所示。下列叙述错误的是( )
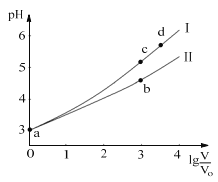
A.溶液中水的电离程度:b点<c点
B.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
C.从c点到d点,溶液中![]() 不变(HA、A-分别代表相应的酸和酸根离子)
不变(HA、A-分别代表相应的酸和酸根离子)
D.若两溶液无限稀释,则它们的c(H+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以方铅矿(PbS)为原料制备铅蓄电池的电极材料的工艺流程如图所示: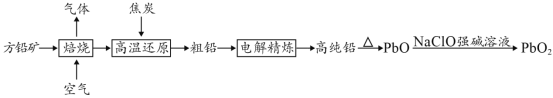
请回答下列问题:
(1)“焙烧”生成的气体直接排放可能造成的环境问题是____________,“焙烧”前须将方铅矿研磨粉粹的目的是________________________________。
(2)电解时,如c(Pb2+)远大于c(H+),则Pb2+优先于H+放电,工业上应用此原理可对铅进行电解精炼。“粗铅”的杂质主要有锌、铁、铜、银等,则阳极泥的主要成分为_________。
(3)写出制备PbO2的离子方程式________________________。
(4)已知部分含铅化合物的Ksp如下表所示:
物质 | PbCl2 | PbS |
Ksp | 1.2×10-5 | 9.0×10-29 |
①铅与稀盐酸反应产生少量气泡后反应终止,原因是_____________________。
②Pb(NO3)2是强酸弱碱盐,氢硫酸是弱酸[Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15],已知K>105时可以认为反应基本完全,通过计算判断向Pb(NO3)2溶液中通入H2S气体能否形成PbS沉淀___________________。(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数![]() (X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是
(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是![]()
![]()
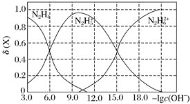
A.Kb1(N2H4)=10-6
B.反应![]() 的pK=9.0(已知:Pk=-lgK)
的pK=9.0(已知:Pk=-lgK)
C.N2H5Cl溶液中c(H+)>c(OH-)
D.N2H5Cl溶液中存在c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(物质结构与性质)
硅电池、锂离子电池都是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(l) LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的立体构型为____。P、O、S的电负性从大到小的顺序为______________
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸 常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗坏血酸中碳原子的杂化方式为 ___,1mol抗坏血酸中手性碳原子的数目为______。(取材于选修3课本51页)。
常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗坏血酸中碳原子的杂化方式为 ___,1mol抗坏血酸中手性碳原子的数目为______。(取材于选修3课本51页)。
(3) Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是____(填标号)。
A.![]() B.
B. C.
C.![]() D.
D.
(4)目前最常用的电极材料有锂钴复合氧化物和石墨。
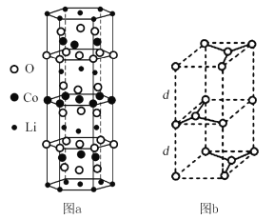
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li-O-Co-O-Li–O-Co-O- Li--顺序排列,则该化合物的化学式为____,Co3+的价层电子排布式为_____。
②石墨晶胞(图b)层间距为d pm,C—C键长为a pm,石墨晶体的密度为p g/cm3,列式表示阿伏加德罗常数为____mol-l。
(5)硅酸盐中Si元素一般显+4价,如下图所示是一种无限长单键的多聚硅酸根离子的结构,其中“![]() ”表示Si原子,“
”表示Si原子,“![]() ”表示氧原子,则该长链硅酸根离子的通式为________________________。
”表示氧原子,则该长链硅酸根离子的通式为________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不能正确表示体系颜色变化的是
A.向AgCl悬浊液中加入Na2S溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)
Ag2S(s)+2Cl-(aq)
B.向酸性KMnO4溶液中加入NaHSO3固体,溶液紫色褪去:2MnO4-+5SO32-+6H+===2Mn2++5SO42-+3H2O
C.向橙色K2Cr2O7溶液中加入NaOH溶液,溶液变黄色:Cr2O72-+2OH-![]() 2CrO42-+H2O
2CrO42-+H2O
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。
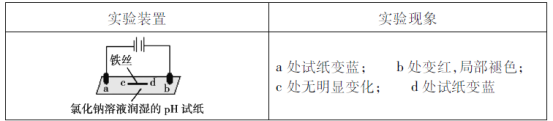
下列对实验现象的解释或推测不合理的是
A.a为电解池的阴极
B.b处有氯气生成,且与水反应生成了盐酸和次氯酸
C.c处发生了反应:Fe-3e-=Fe3+
D.d处:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法,氨还可以进一步用来合成尿素、生产纯碱。
(1)写出氨分子的电子式______,其中氮原子有_____种能量不同的电子,氮原子的轨道表示式__________。
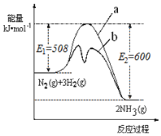
(2)根据如图提供的信息,写出该反应的热化学方程式___________________,右图的曲线中______(填“a”或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
(3)在恒容容器中,下列描述中能说明上述反应已达平衡的是______。
A 3v(H2)正=2v(NH3)逆
B 单位时间内生成nmolN2的同时生成2nmolNH3
C 容器内气体的密度不随时间的变化而变化
D 容器内压强不随时间的变化而变化
(4)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n(N2)/n(H2) | P(MPa) |
1 | 450 | 1/3 | 1 |
2 | ________ | 1/3 | 10 |
3 | 480 | _________ | 10 |
(5)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。图为合成塔中不同氨碳比a
CO(NH2)2(l)+H2O(g)。图为合成塔中不同氨碳比a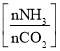 和水碳比b
和水碳比b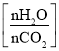 时二氧化碳转化率(α)。b宜控制在_______(填字母)范围内。
时二氧化碳转化率(α)。b宜控制在_______(填字母)范围内。
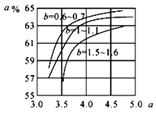
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.6 D. 1~1.6
a宜控制在4.0左右,理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,能达到相应实验目的的是
|
|
|
|
A.制备并收集乙酸乙酯 | B.证明氯化银溶解度大于硫化银 | C.验证溴乙烷的消去产物是乙烯 | D.推断S、C、Si的非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com