
【题目】用石墨电极完成下列电解实验。
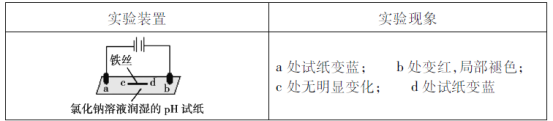
下列对实验现象的解释或推测不合理的是
A.a为电解池的阴极
B.b处有氯气生成,且与水反应生成了盐酸和次氯酸
C.c处发生了反应:Fe-3e-=Fe3+
D.d处:2H2O+2e-=H2↑+2OH-
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种物质直接的转化如图所示,其中不能一步实现的是( )

A | B | C | D | |
X | C | NaOH | CH3CH2OH | N2 |
Y | CO | Na2CO3 | CH3CHO | NH3 |
Z | CO2 | NaHCO3 | CH3COOH | NO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+yB(g) ![]() zC(g),图1表示200℃时容器中A、B、C物质的量随时间的变化,图2表示温度与C的体积分数的变化关系,则下列结论正确的是
zC(g),图1表示200℃时容器中A、B、C物质的量随时间的变化,图2表示温度与C的体积分数的变化关系,则下列结论正确的是
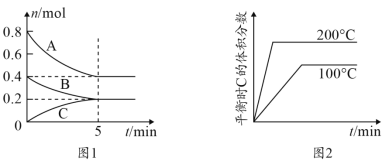
A.由图可知该反应为2A(g)+B(g) ![]() C(g) ΔH<0
C(g) ΔH<0
B.200℃,该反应的平衡常数为25
C.200℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
D.当外界条件由200℃降温到100℃,原平衡被破坏,且正逆反应速率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员研制出一种新型储备电源-锂水电池(结构如图,高硅铸铁为惰性辅助电极),使用时加入水即可放电。下列关于该电池工作时的说法正确的是
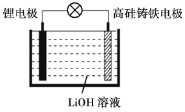
A.高硅铸铁发生氧化反应B.OH-向高硅铸铁电极移动
C.负极的电极反应式为Li-e-=Li+D.电流的方向:锂电极→导线→高硅铸铁电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,则△H<0
B.铁片镀锌时,铁片与外电源的正极相连
C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)![]() NO(g)+SO3(g),通入少量O2,
NO(g)+SO3(g),通入少量O2,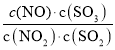 的值及SO2转化率不变
的值及SO2转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期元素Q位于ds区,最外层电子半充满;短周期元素W、X、Y、Z第一电离能与原子序数的关系如下图所示,请回答下列问题(用Q、W、X、Y、Z所对应的元素符号作答):
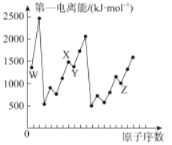
(1)基态Y原子核外共有___种运动状态不相同的电子。若用n表示能层,则与Y元素同族的元素的基态原子的价电子排布式为_________________。
(2)X、W组成的一种二元化合物常用作火箭燃料,该化合物中X原子的杂化方式为___________。该化合物常温下呈液态,其沸点高于Y2沸点的原因为___________。
(3)X2Y曾被用作麻醉剂,根据“等电子体原理”预测X2Y的空间构型为______________。
(4)XW3存在孤电子对,可形成[Q(XW3)4]2+离子,该离子中不存在_____________(填序号)。
A.极性共价键 B.非极性共价键 C.配位键 D.σ键 E.π键
(5)Q与X形成的一种二元化合物的立方晶胞结构如图所示:
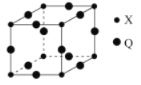
①Q原子周围距其距离最近的Q原子的数目为_______。
②该二元化合物的化学式为___________________。
(6)已知单质Q晶体的堆积方式为面心立方最密堆积,则单质Q晶体的晶胞中原子的空间利用率为_________________(用含π的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下分别测得反应2SO2+O2![]() 2SO3的化学反应速率,其中表示该反应进行得最快的是( )
2SO3的化学反应速率,其中表示该反应进行得最快的是( )
A.v(SO2)=4mol/(L·min)B.v(O2)=3mol/(L·min)
C.v(SO2)=0.1mol/(L·s)D.v(O2)=0.1mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铝陶瓷常用于厚膜集成电路,制备氧化铝陶瓷的工艺流程如图所示,回答下列问题。
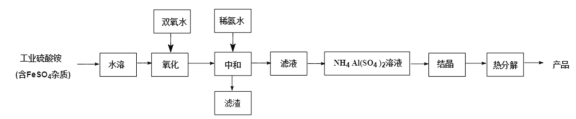
(1)“氧化”步骤发生的离子方程式为:________, 使用双氧水作氧化剂优点为:______________。
(2)“热分解”得到的产物除了氧化铝外,还有 NH3、N2、SO2、SO3、H2O 生成,则氧化 产物和还原产物的物质的量之比为______________。
(3)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失
重计算值( 失重计算值(%)![]() )如表所示:
)如表所示:
温度区间(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
失重计算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
通过上述数据经粗略计算可判断,在______________温度区间铵明矾基本上失去了全部结晶水。
(4)“结晶”步骤中常采用的操作是_____
(5)该流程中常使用过量的工业硫酸铵,利用硫酸铵水解使溶液显酸性抑制硫酸铝水解, 这样做的目的是:______________。
(6)通常认为金属离子浓度等于 1×10-5mol/L 即可认为沉淀完全,试计算常温下“中和”步 骤中需要调节溶液 pH=______________(保留一位小数,已知:Ksp[Fe(OH)3 ]=8.0×10-38, lg5=0.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)俗称蚁醛,是一种重要的化工原料。可通过以下方法将甲醇转化为甲醛。
脱氢法:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09 kJ·mol-1
氧化法:CH3OH(g)+![]() O2(g)=HCHO(g)+H2O(g)ΔH2
O2(g)=HCHO(g)+H2O(g)ΔH2
回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-483.64 kJ·mol-1,则ΔH2=_________________。
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因为________________________________________。
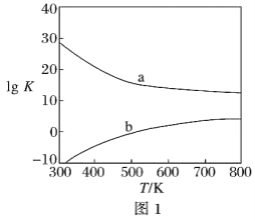
(3)图1为甲醇制备甲醛反应的lg K(K为平衡常数)随温度(T)的变化曲线。曲线_____(填“a”或“b”)对应脱氢法,判断依据是_____________________________________。
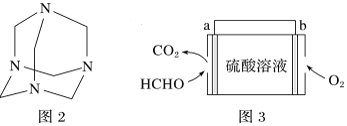
(4)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为___________。
(5)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图3所示,则a极的电极反应式为_________________________________________________,当电路中转移4×10-4 mol电子时,传感器内参加反应的HCHO为________________mg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com