
【题目】氧化铝陶瓷常用于厚膜集成电路,制备氧化铝陶瓷的工艺流程如图所示,回答下列问题。
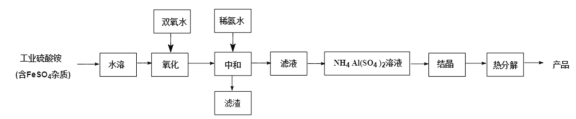
(1)“氧化”步骤发生的离子方程式为:________, 使用双氧水作氧化剂优点为:______________。
(2)“热分解”得到的产物除了氧化铝外,还有 NH3、N2、SO2、SO3、H2O 生成,则氧化 产物和还原产物的物质的量之比为______________。
(3)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失
重计算值( 失重计算值(%)![]() )如表所示:
)如表所示:
温度区间(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
失重计算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
通过上述数据经粗略计算可判断,在______________温度区间铵明矾基本上失去了全部结晶水。
(4)“结晶”步骤中常采用的操作是_____
(5)该流程中常使用过量的工业硫酸铵,利用硫酸铵水解使溶液显酸性抑制硫酸铝水解, 这样做的目的是:______________。
(6)通常认为金属离子浓度等于 1×10-5mol/L 即可认为沉淀完全,试计算常温下“中和”步 骤中需要调节溶液 pH=______________(保留一位小数,已知:Ksp[Fe(OH)3 ]=8.0×10-38, lg5=0.7)。
【答案】2Fe2++H2O2+2H+==2Fe3++2H2O 不引入杂质、不污染环境 1:3 190→430 蒸发浓缩、冷却结晶 提高硫酸铝的利用率 3.3
【解析】
根据流程图分析知,工业硫酸铵溶于水后,用双氧水氧化,其中硫酸亚铁杂质被氧化生成硫酸铁,加入稀氨水中和后生成氢氧化铁沉淀,滤渣为氢氧化铁;滤液为硫酸铝铵溶液,浓缩后降温结晶得到硫酸铝铵晶体,加热分解后得到产品,据此分析解答。
(1)亚铁离子被双氧水氧化生成铁离子,离子方程式为:2Fe2++H2O2+2H+==2Fe3++2H2O;由反应产物知,使用双氧水作氧化剂优点为:不引入杂质、不污染环境,故答案为:2Fe2++H2O2+2H+==2Fe3++2H2O;不引入杂质、不污染环境;
(2)根据元素化合价变化分析,N2中N元素由反应物中-3价升高为0价,为氧化产物,SO2中S元素由反应物中的+6价降低为+4价,为还原产物,设氧化产物为xmol,还原产物为ymol,根据得失电子守恒得,xmol×3×2=ymol×(6-4),则![]() ,故答案为:1:3;
,故答案为:1:3;
(3)根据明矾晶体中水的质量分数![]() ,则在190→430温度区间铵明矾基本上失去全部结晶水,故答案为:190→430;
,则在190→430温度区间铵明矾基本上失去全部结晶水,故答案为:190→430;
(4)温度过高,晶体易分解,所以“结晶”步骤中常采用的操作是蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶;
(5)该流程中常使用过量的工业硫酸铵,利用硫酸铵水解使溶液显酸性抑制硫酸铝水解, 这样做的目的是:提高硫酸铝的利用率,故答案为:提高硫酸铝的利用率;
(6)Ksp[Fe(OH)3 ]=![]() =8.0×10-38,则
=8.0×10-38,则![]() ,
,![]() ,p H=-lgc(H+)=4-lg5=3.3,故答案为:3.3。
,p H=-lgc(H+)=4-lg5=3.3,故答案为:3.3。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】以方铅矿(PbS)为原料制备铅蓄电池的电极材料的工艺流程如图所示: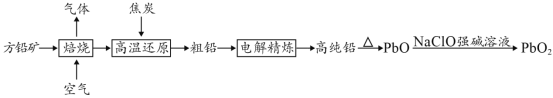
请回答下列问题:
(1)“焙烧”生成的气体直接排放可能造成的环境问题是____________,“焙烧”前须将方铅矿研磨粉粹的目的是________________________________。
(2)电解时,如c(Pb2+)远大于c(H+),则Pb2+优先于H+放电,工业上应用此原理可对铅进行电解精炼。“粗铅”的杂质主要有锌、铁、铜、银等,则阳极泥的主要成分为_________。
(3)写出制备PbO2的离子方程式________________________。
(4)已知部分含铅化合物的Ksp如下表所示:
物质 | PbCl2 | PbS |
Ksp | 1.2×10-5 | 9.0×10-29 |
①铅与稀盐酸反应产生少量气泡后反应终止,原因是_____________________。
②Pb(NO3)2是强酸弱碱盐,氢硫酸是弱酸[Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15],已知K>105时可以认为反应基本完全,通过计算判断向Pb(NO3)2溶液中通入H2S气体能否形成PbS沉淀___________________。(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。
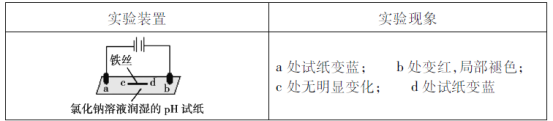
下列对实验现象的解释或推测不合理的是
A.a为电解池的阴极
B.b处有氯气生成,且与水反应生成了盐酸和次氯酸
C.c处发生了反应:Fe-3e-=Fe3+
D.d处:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法,氨还可以进一步用来合成尿素、生产纯碱。
(1)写出氨分子的电子式______,其中氮原子有_____种能量不同的电子,氮原子的轨道表示式__________。
(2)根据如图提供的信息,写出该反应的热化学方程式___________________,右图的曲线中______(填“a”或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
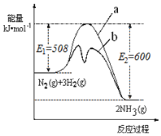
(3)在恒容容器中,下列描述中能说明上述反应已达平衡的是______。
A 3v(H2)正=2v(NH3)逆
B 单位时间内生成nmolN2的同时生成2nmolNH3
C 容器内气体的密度不随时间的变化而变化
D 容器内压强不随时间的变化而变化
(4)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n(N2)/n(H2) | P(MPa) |
1 | 450 | 1/3 | 1 |
2 | ________ | 1/3 | 10 |
3 | 480 | _________ | 10 |
(5)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。图为合成塔中不同氨碳比a
CO(NH2)2(l)+H2O(g)。图为合成塔中不同氨碳比a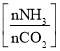 和水碳比b
和水碳比b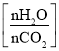 时二氧化碳转化率(α)。b宜控制在_______(填字母)范围内。
时二氧化碳转化率(α)。b宜控制在_______(填字母)范围内。
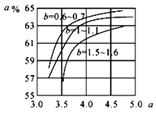
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.6 D. 1~1.6
a宜控制在4.0左右,理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100℃时,0.01mol·L-1NaHSO4溶液中水电离的c(H+)=10-10mol·L-1,该温度下将pH=8的Ba(OH)2溶液V1L与pH=5的NaHSO4溶液V2L混合,所得溶液pH=7,则V1:V2为( )
A.2:9B.9:2C.1:9D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。下图为一套浓差电池和电解质溶液再生的配套装置示意图,闭合开关K之前,两个Cu电极的质量相等。下列有关这套装置的说法中错误的是

A. 循环物质E为水
B. 乙池中Cu电极为阴极,发生还原反应
C. 甲池中的电极反应式为Cu2++2e-=Cu
D. 若外电路中通过1mol电子,两电极的质量差为64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解法制取 Na2FeO4 的装置图如图所示,下列说法正确的是(电解过程中温度保 持不变,溶液体积变化忽略不计)
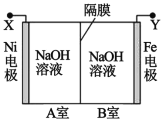
A.Y 是外接电源的正极,Fe 电极上发生还原反应
B.Ni 电极上发生的电极反应为:2H2O - 4e-== O2↑+4H+
C.若隔膜为阴离子交换膜,则电解过程中 OH-由 B 室进入 A 室
D.电解后,撤去隔膜,充分混合,电解液的 pH 比原来小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,能达到相应实验目的的是
|
|
|
|
A.制备并收集乙酸乙酯 | B.证明氯化银溶解度大于硫化银 | C.验证溴乙烷的消去产物是乙烯 | D.推断S、C、Si的非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com