
【题目】合成氨是目前最有效工业固氮的方法,解决数亿人口生存问题。回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

由图可知合成氨反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的H=___ kJ·mol-1。该历程中反应速率最慢的步骤的化学方程式为___。
NH3(g)的H=___ kJ·mol-1。该历程中反应速率最慢的步骤的化学方程式为___。
(2)工业合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:

①500℃时,反应平衡常数Kp(30MPa)___ Kp(100MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为___(保留2位有效数字),Kp=___(MPa)-2(列出计算式)。
(3)科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观示意如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。

①阴极区生成NH3的电极方程式为___。
②下列说法正确的是___(填标号)。
A.三氟甲磺酸锂的作用是增强导电性
B.该装置用金(Au)作催化剂目的是降低N2的键能
C.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
【答案】-46 Nad+3Had![]() NHad+2Had = 33%
NHad+2Had = 33%  N2+6e-+6C2H5OH=2NH3+6C2H5O- AC
N2+6e-+6C2H5OH=2NH3+6C2H5O- AC
【解析】
(1)利用盖斯定律,起点为![]() N2(g)+
N2(g)+![]() H2(g),终点为NH3(g),H=-46kJ·mol-1。该历程中反应速率最慢反应,是需吸热最多的反应,显然是吸热106 kJ·mol-1的反应。
H2(g),终点为NH3(g),H=-46kJ·mol-1。该历程中反应速率最慢反应,是需吸热最多的反应,显然是吸热106 kJ·mol-1的反应。
(2)①500℃时,平衡常数不变。
②500℃、30MPa时,氨气的体积分数为20%,利用三段式,计算氢气平衡转化率及Kp。
(3)①从图中看,阴极区N2与C2H5OH反应生成NH3和C2H5O-。
②A.从阴极反应看,三氟甲磺酸锂并未参与反应,所以作用是增强导电性;
B.催化剂只能降低反应的活化能,不能降低键能;
C.从图中看,选择性透过膜可允许N2和NH3通过,但H2O不能透过。
(1)利用盖斯定律,起点为![]() N2(g)+
N2(g)+![]() H2(g),终点为NH3(g),H=-46 kJ·mol-1。所以,合成氨反应
H2(g),终点为NH3(g),H=-46 kJ·mol-1。所以,合成氨反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g) ![]() NH3(g) H=-46 kJ·mol-1。该历程中反应速率最慢的反应,是需吸热最多的反应,显然是吸热106 kJ·mol-1的反应,化学方程式为Nad+3Had
NH3(g) H=-46 kJ·mol-1。该历程中反应速率最慢的反应,是需吸热最多的反应,显然是吸热106 kJ·mol-1的反应,化学方程式为Nad+3Had![]() NHad+2Had。答案为:利用盖斯定律,起点为
NHad+2Had。答案为:利用盖斯定律,起点为![]() N2(g)+
N2(g)+![]() H2(g),终点为NH3(g),H=-46kJ·mol-1;Nad+3Had
H2(g),终点为NH3(g),H=-46kJ·mol-1;Nad+3Had![]() NHad+2Had;
NHad+2Had;
(2)①因为平衡常数只受温度变化的影响,所以500℃时,反应平衡常数Kp(30MPa)= Kp(100MPa);
②设参加反应N2的物质的量为x,建立三段式为:

则![]() ,x=
,x=![]() ,则N2的体积分数为
,则N2的体积分数为![]() =20%,H2的体积分数为60%,NH3的体积分数为20%。
=20%,H2的体积分数为60%,NH3的体积分数为20%。
500℃、30MPa时,氢气的平衡转化率为![]() =33%,Kp=
=33%,Kp= (MPa)-2;
(MPa)-2;
(3)①从图中看,阴极区N2与C2H5OH反应生成NH3和C2H5O-,电极方程式为N2+6e-+6C2H5OH=2NH3+6C2H5O-;
②A.从阴极反应看,三氟甲磺酸锂并未参与反应,所以作用是增强导电性,A正确;
B.催化剂只能降低反应的活化能,不能降低键能,B不正确;
C.从图中看,选择性透过膜可允许N2和NH3通过,但H2O不能透过,C正确;
故合理选项是AC。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,且Y、Q形成一种共价化合物,X的最高价氧化物对应的水化物可与Y单质反应产生常见的还原性气体单质E。下列说法正确的是
A.X、Y、Q对应简单离子的半径逐渐减小
B.工业上可用电解X、Q元素组成的化合物的饱和溶液制备Q单质
C.Y、Q形成的化合物是非电解质
D.工业用W与Z的最高价氧化物反应制取Z单质,同时得到W的最高价氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化铬的化学式为 CrO5,从其结构发现含有 2 个过氧键,结构如图, 下列说法不正确的是

A.CrO5可能具有强氧化性
B.CrO5 溶于水可能放出氧气
C.CrO5 稳定性较低,易分解
D.CrO5 中 Cr 的化合价为+10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三锰(Mn3O4)广泛应用于生产软磁材料、催化材料制备领域。一种以低品位锰矿(含MnCO3、Mn2O3、MnOOH及少量Fe2O3、Al2O3、SiO2)为原料生产Mn3O4的工艺流程如图:

已知:(NH4)2SO4![]() NH3↑+NH4HSO4
NH3↑+NH4HSO4
回答下列问题:
(1)MnOOH中Mn的化合价为___。
(2) “溶浸”中H2O2的作用是___。
(3) “滤渣2”的主要成分有___。
(4) “母液”溶质的主要成分是___,循环利用该物质的方案是___。
(5)氧化”时,将固体加入水中,70℃水浴加热,通空气氧化,将固体全部转化为Mn3O4。Mn(OH)2生成Mn3O4的化学方程式为___。反应后溶液pH___(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HCOOH和CH3COOH的电离常数分别1.80×104和1.75×105。将pH=3,体积均为V0的两种酸溶液分别加水稀释至体积V,pH随lg![]() 的变化如图所示。下列叙述错误的是( )
的变化如图所示。下列叙述错误的是( )
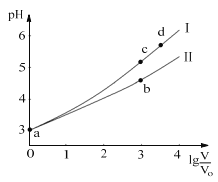
A.溶液中水的电离程度:b点<c点
B.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
C.从c点到d点,溶液中![]() 不变(HA、A-分别代表相应的酸和酸根离子)
不变(HA、A-分别代表相应的酸和酸根离子)
D.若两溶液无限稀释,则它们的c(H+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应: X2(g)+Y 2(g) ![]() 2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z 为 0.3mol/LB.Y2 为 0.4mol/LC.X2 为 0.2mol/LD.Z 为 0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种浓差电池如图所示,阴、阳离子交换膜交替放置,中间的间隔交替充以河水和海水,选择性透过Cl和Na+,在两电极板形成电势差,进而在外部产生电流。下列关于该电池的说法正确的是( )

A.a电极为电池的正极,电极反应为2H++2e═H2↑
B.C为阴离子交换膜,A为阳离子交换膜
C.负极隔室的电中性溶液通过阳极表面的还原作用维持
D.该电池的缺点是离子交换膜价格昂贵,优点是电极产物有经济价值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些稠环环芳烃的结构简式如图,下列说法正确的是( )
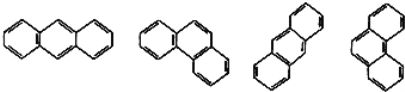
A. 这些结构简式表示的化合物有3种
B. 它们的分子式不相同
C. 所有原子均在同一平面
D. 它们与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不能正确表示体系颜色变化的是
A.向AgCl悬浊液中加入Na2S溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)
Ag2S(s)+2Cl-(aq)
B.向酸性KMnO4溶液中加入NaHSO3固体,溶液紫色褪去:2MnO4-+5SO32-+6H+===2Mn2++5SO42-+3H2O
C.向橙色K2Cr2O7溶液中加入NaOH溶液,溶液变黄色:Cr2O72-+2OH-![]() 2CrO42-+H2O
2CrO42-+H2O
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com