
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
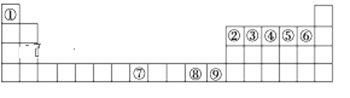
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,元素⑦位于周期表的___区。
(2)写出元素③与元素⑤形成的稳定化合物的结构式___________。
(3)②、⑥两元素形成的化合物的立体构型为_______,其中心原子的杂化轨道类型为______。
(4)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于_____晶体(填晶体类型)。
(5)⑧的二价阳离子与过量的④的简单氢化物的水溶液作用的离子方程式_________。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为____。
(7)将①、⑥形成的化合物溶于水,其中可能存在的氢键表示为_______(写一种即可)。
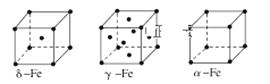
(8)金属⑦有δ、γ、α三种同素异形体,各晶胞如下图,则δ和α中原子的配位数之比为______。
【答案】d O=C=O 平面三角形 sp2杂化 分子晶体 Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O 配位键 F-H…F、F-H…O、O-H…F、O-H…O 4:3
【解析】
由元素在周期表中位置,可知①为H、②为B、③为C、④为N、⑤为O、⑥为F、⑦为Fe、⑧为Cu、⑨为Zn,据此解答。
(1)⑦为Fe,铁原子的核外电子排布式为:1s22s22p63s23p63d64s2,处于周期表中d区;
(2)元素③与元素⑤形成的稳定化合物为二氧化碳,其结构式为:O=C=O;
(3)②为B,⑥为F,形成的化合物为BF3,中心原子B的价层电子对数=3+![]() (3-1×3)=3,立体构型为平面三角形,其中心原子的杂化轨道类型为sp2杂化;
(3-1×3)=3,立体构型为平面三角形,其中心原子的杂化轨道类型为sp2杂化;
(4)元素⑦与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点低,易溶于非极性溶剂,属于分子晶体;
(5)元素⑧为铜元素,④为氮元素,其氢化物的水化物为氨水,铜离子与氨水反应生成铜氨配离子和水,反应的离子方程式为:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O;
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中生成配离子,Zn2+离子与NH3间结合的作用力为配位键;
(7)①为H,⑥为F,①、⑥形成的化合物为HF,溶于水,HF分子间和水分子间以及HF分子和水分子间都可形成氢键,氢键表示为F-H…F、F-H…O、O-H…F、O-H…O(写一种即可);
(8)δ为体心立方堆积,配位数为8;α为简单立方堆积,配位数为6,则δ和α中原子的配位数之比为8:6=4:3。


科目:高中化学 来源: 题型:
【题目】下列离子方程式不能正确表示体系颜色变化的是
A.向AgCl悬浊液中加入Na2S溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)
Ag2S(s)+2Cl-(aq)
B.向酸性KMnO4溶液中加入NaHSO3固体,溶液紫色褪去:2MnO4-+5SO32-+6H+===2Mn2++5SO42-+3H2O
C.向橙色K2Cr2O7溶液中加入NaOH溶液,溶液变黄色:Cr2O72-+2OH-![]() 2CrO42-+H2O
2CrO42-+H2O
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。下图为一套浓差电池和电解质溶液再生的配套装置示意图,闭合开关K之前,两个Cu电极的质量相等。下列有关这套装置的说法中错误的是

A. 循环物质E为水
B. 乙池中Cu电极为阴极,发生还原反应
C. 甲池中的电极反应式为Cu2++2e-=Cu
D. 若外电路中通过1mol电子,两电极的质量差为64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒及其化合物在工业上有许多用途。某钒精矿的主要成分及质量分数如下表:
物质 | V2O5 | V2O3 | K2O | SiO2 | Fe2O3 | Al2O3 |
质量分数% | 0.81 | 1.70 | 2.11 | 63.91 | 5.86 | 12.51 |
一种从该钒精矿中提取五氧化二钒的流程如下:
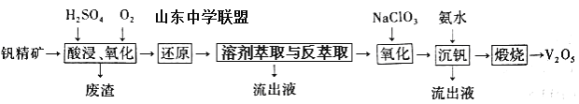
回答下列问题:
(1)“酸浸、氧化”时,V2O3转化为VO2+,反应的离子方程式为____________________________________;若用浓盐酸代替硫酸,V2O5转化为VO2+,同时生成有毒的黄绿色气体,反应的化学方程式为__________________。
(2)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用____________(填名称,下同)对浸出液进行“还原”处理。为检验“还原”后的滤液中是否含有Fe3+,可选用的化学试剂是____________________。
(3)“溶剂萃取与反萃取”可表示为:VO2+ + (HR2PO4)2(O)![]() VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
(4)“氧化”中,欲使3molVO2+变为VO2+,则需要氧化剂NaClO3至少为____________mol。
(5)单质钒可用于制造特种合金钢。以五氧化二钒和金属钙为原料在高温条件下可制备单质钒,表示制备过程的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,能达到相应实验目的的是
|
|
|
|
A.制备并收集乙酸乙酯 | B.证明氯化银溶解度大于硫化银 | C.验证溴乙烷的消去产物是乙烯 | D.推断S、C、Si的非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4 作内相酸处理含铜废水。 在其他条件相同时,Cu2+萃取率[萃取率= ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
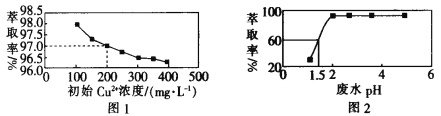
A.根据图 1 可知,废水中初始 Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图 2 可知,废水初始 pH>2 时,去除 Cu2+的效果较好
C.根据图 1 可知,Cu2+初始浓度为 200 mg·L-1 时,Cu2+的萃取率为 97.0%
D.根据图 2 可知,若取 800 mL 初始 Cu2+浓度为 200 mg·L-1 的废水,在 pH=1.5 时处理废水,则处理后的废水中剩余 Cu2+的物质的量为 1.5×10-3mol(假设体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾的分类收集是实现垃圾处理无害化、减量化和资源化的重要措施。向贴有如下图所示标志的垃圾箱中丢弃的垃圾应是

A.厨房垃圾B.可回收垃圾C.有害垃圾D.其他垃圾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2(黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收和释放进行了研究。
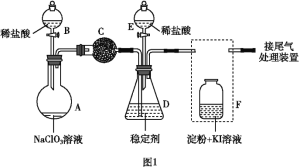
(1)仪器A的名称是_______________________。
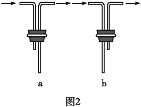
(2)安装F中导管时,应选用图2中的___________________。
(3)A中发生反应生成ClO2和Cl2,其氧化产物和还原产物物质的量之比为__________。
(4)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是__________________。
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为____。
(6)ClO2很不稳定,需随用随制,产物用水吸收可得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样,量取V0 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L1 Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V1 mL。
(已知2ClO2+10I+8H+=2Cl+5I2+4H2O 2Na2S2O3+I2![]() Na2S4O6+2NaI)
Na2S4O6+2NaI)
计算该ClO2的浓度为______g/L(用含字母的代数式表示,计算结果化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KH2PO4在农业上用作高效磷钾复合肥,在化学工业中还用作制偏磷酸钾的原料。一种电解法制备KH2PO4的装置如图所示。下列说法错误的是( )
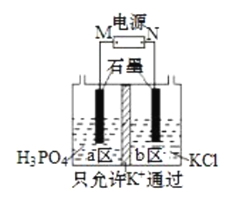
A.电源M极为负极,a区生成KH2PO4
B.b区电极反应为:4OH--4e-=O2↑+2H2O
C.电解过程中a区水的电离平衡正向移动
D.当0.1molK+通过离子交换膜时,阴阳两极产生的气体共2.24L(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com