
【题目】钒及其化合物在工业上有许多用途。某钒精矿的主要成分及质量分数如下表:
物质 | V2O5 | V2O3 | K2O | SiO2 | Fe2O3 | Al2O3 |
质量分数% | 0.81 | 1.70 | 2.11 | 63.91 | 5.86 | 12.51 |
一种从该钒精矿中提取五氧化二钒的流程如下:
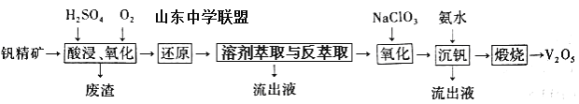
回答下列问题:
(1)“酸浸、氧化”时,V2O3转化为VO2+,反应的离子方程式为____________________________________;若用浓盐酸代替硫酸,V2O5转化为VO2+,同时生成有毒的黄绿色气体,反应的化学方程式为__________________。
(2)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用____________(填名称,下同)对浸出液进行“还原”处理。为检验“还原”后的滤液中是否含有Fe3+,可选用的化学试剂是____________________。
(3)“溶剂萃取与反萃取”可表示为:VO2+ + (HR2PO4)2(O)![]() VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
(4)“氧化”中,欲使3molVO2+变为VO2+,则需要氧化剂NaClO3至少为____________mol。
(5)单质钒可用于制造特种合金钢。以五氧化二钒和金属钙为原料在高温条件下可制备单质钒,表示制备过程的化学方程式为________________________________________。
【答案】2V2O3+8H++O2=4VO2++4H2O V2O5+6HCl(浓)=2VOCl2+Cl2+3H2O 铁粉 硫氰酸钾溶液 酸 0.5 V2O5+5Ca![]() 2V+5CaO
2V+5CaO
【解析】
钒精矿经硫酸酸浸、氧气氧化得到滤液和废渣,滤液中主要阳离子有VO2+、VO2+、Fe3+、K+、Al3+,滤渣主要为SiO2;萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用铁粉将铁离子还原成亚铁离子,同时也将VO2+还原成VO2+,再经“溶剂萃取与反萃取”得到含VO2+的溶液,然后利用NaClO3将VO2+氧化成VO2+,加入氨水得到NH4VO3沉淀,煅烧得到五氧化二钒。
(1)“酸浸、氧化”时,V2O3转化为VO2+,该过程中氧气做氧化剂,V2O3为还原剂,结合电子守恒和元素守恒可得方程式为2V2O3+8H++O2=4VO2++4H2O;浓盐酸为还原性酸,V2O5转化为VO2+,同时将盐酸氧化成氯气,结合电子守恒和元素守恒可知方程为V2O5+6HCl(浓)=2VOCl2+Cl2+3H2O;
(2)根据分析可知萃取前可用铁粉对浸出液进行“还原”处理;铁离子与硫氰酸钾溶液反应呈红色,可用硫氰酸钾溶液检验是否含有铁离子;
(3)为了提高VO2+的产率需要平衡左移,则需要溶液中有大量氢离子,所以反萃取剂应呈酸性;
(4)VO2+变为VO2+,化合价升高1价,则使3molVO2+变为VO2+需要转移3mol电子,氧化剂NaClO3被还原成Cl-,化合价降低6价,所以转移3mol电子需要0.5molNaClO3;
(5)该过程中高温条件下钙还原五氧化二钒得到单质钒,方程式为V2O5+5Ca![]() 2V+5CaO。
2V+5CaO。


 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】乙烯、苯乙烯均是重要的化工原料。
![]() 工业上可用乙苯催化脱氢方法制备苯乙烯
工业上可用乙苯催化脱氢方法制备苯乙烯
①已知部分化学键的键能如下:
化学键 | C-H | C-C |
| H-H |
键能/(kJ/mol) | 412 | 348 | 612 | 436 |
则![]() +H2(g)的
+H2(g)的![]() ________kJ/mol。
________kJ/mol。
②实际生产中常在恒压条件下掺入高温水蒸气作为反应体系的稀释剂![]() 水蒸气不参加反应
水蒸气不参加反应![]() 。在一定压强、900 K的条件下,乙苯的平衡转化率随着
。在一定压强、900 K的条件下,乙苯的平衡转化率随着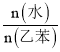 的增大而________
的增大而________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() 。随着反应的进行,少量积碳会使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是____________
。随着反应的进行,少量积碳会使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是____________![]() 用化学方程式表示
用化学方程式表示![]() 。
。
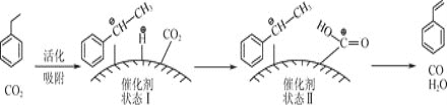
![]() 苯乙烯可由乙苯和
苯乙烯可由乙苯和![]() 催化脱氢制得。其反应历程如下:
催化脱氢制得。其反应历程如下:
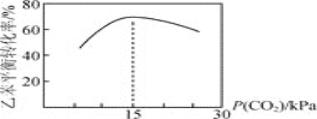
乙苯平衡转化率与![]() 的关系如图所示,当P(CO2)< 15 kPa时,乙苯平衡转化率随着
的关系如图所示,当P(CO2)< 15 kPa时,乙苯平衡转化率随着![]() 增大而增大,其原因是__________,当P(CO2)> 15 kPa时,乙苯平衡转化率随着
增大而增大,其原因是__________,当P(CO2)> 15 kPa时,乙苯平衡转化率随着![]() 增大反而减小,其原因是____________。
增大反而减小,其原因是____________。
![]() 研究表明金属次卟啉二甲酯能够顺利地选择性催化氧化苯乙烯生成苯甲醛,以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为 ________。若该电池消耗标准状况下22.4L的
研究表明金属次卟啉二甲酯能够顺利地选择性催化氧化苯乙烯生成苯甲醛,以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为 ________。若该电池消耗标准状况下22.4L的![]() ,则外电路中理论上转移电子的物质的量为________。
,则外电路中理论上转移电子的物质的量为________。
(4)上海交通大学仇毅翔等研究了不同含金化合物催化乙烯加氢![]() 的反应历程如下图所示:
的反应历程如下图所示:

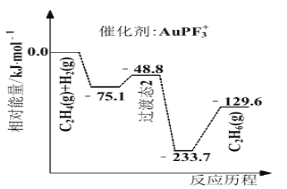
则![]() ____________,催化乙烯加氢效果较好的催化剂是________(选填“
____________,催化乙烯加氢效果较好的催化剂是________(选填“![]() ”或“
”或“![]() ”)。
”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,关于下列溶液混合后溶液pH的说法中正确的是( )
A.pH=10与pH=12的NaOH溶液等体积混合,溶液的pH约为11
B.pH=5的盐酸溶液稀释1000倍,溶液的pH=8
C.pH=2的H2SO4与pH=12的NaOH溶液等体积混合,混合液pH=7
D.pH=12的NH3·H2O与pH=2的HCl溶液等体积混合,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以物质a为原料合成扁桃酸衍生物b的过程如下:下列说法正确的是( )
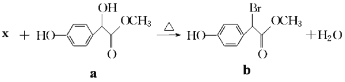
A.物质X是Br2, 物质a转化为b属于取代反应
B.lmol物质a能与3molH2反应,且能在浓硫酸中发生消去反应
C.物质b具有多种能与NaHCO3反应的同分异构体
D.物质b的核磁共振氢谱有四组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.标准状况下,1 g H2和14 g N2的体积相同
B.1 mol氧含6.02×1023个O2分子
C.将15.6gNa2O2固体加入到足量水中,反应过程中转移电子总数为1.204×1023个
D.20g重水(D2O)中含有电子数为6.02×1024个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如下图所示,下列说法中正确的是( )
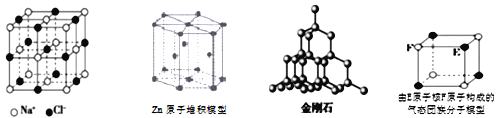
A.在NaCl晶体中,距Na+离子最近且等距的Na+离子有6个
B.金属Zn中Zn原子堆积模型如图所示,空间利用率为68%
C.在金刚石晶体中,碳原子与碳碳键(C—C)数目之比为1:2
D.该气态闭簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
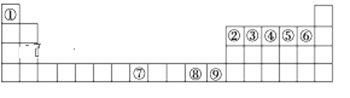
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,元素⑦位于周期表的___区。
(2)写出元素③与元素⑤形成的稳定化合物的结构式___________。
(3)②、⑥两元素形成的化合物的立体构型为_______,其中心原子的杂化轨道类型为______。
(4)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于_____晶体(填晶体类型)。
(5)⑧的二价阳离子与过量的④的简单氢化物的水溶液作用的离子方程式_________。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为____。
(7)将①、⑥形成的化合物溶于水,其中可能存在的氢键表示为_______(写一种即可)。
(8)金属⑦有δ、γ、α三种同素异形体,各晶胞如下图,则δ和α中原子的配位数之比为______。
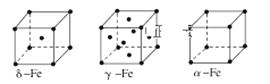
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH所得数据如下:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
雨水的pH | 4.75 | 4.62 | 4.56 | 4.55 | 4.54 |
分析数据,回答以下问题:
①雨水样品呈酸性的原因是________________________________(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水(含有氯气)混合,pH将________(填“变大”“变小”或“不变”)。
(2)测定雨水样品时,每隔一定时间测定一次pH,发现pH逐渐变小,其原因可能是_______(用化学方程式表示)。
(3)举一例说明这种雨水将给环境中的生物或非生物造成的影响________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有Cu、Fe、Al、Co、Li、Si等成分的某合金废料回收利用的工艺流程如图所示。

已知:
①Fe、Co在周期表中属同周期、同族;常温下,pH=7.3时Li+或Co3+开始沉淀。
②有关物质的溶度积(Ksp):
物质 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
Ksp | 4.0×10-21mol3·L-3 | 1.0×10-32mol4·L-4 | 1.0×10-38mol4·L-4 | 8.0×10-19mol3·L-3 |
回答下列问题
(1)Na2CO3溶液可作为合金废料的油污除剂,用离子方程式表示其原理__。
(2)“浸出渣”中的物质为__。
(3)①“浸出液”加入双氧水的作用是__(用离子方程式表示)。
②氨水的作用是调节溶液的pH,常温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol·L-1认为完全沉淀)。需调节溶液的pH范围为__。
(4)得到的CoC2O4·2H2O晶体在空气中充分焙烧可得Co2O3,化学方程式为__。
(5)已知Li2CO3微溶于水,其饱和溶液的浓度与温度的关系如表所示。
温度/℃ | 10 | 30 | 60 |
浓度/(mol·L-1) | 0.21 | 0.17 | 0.14 |
则操作X为蒸发浓缩、__,理由是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com