
【题目】下列说法中不正确的是( )
A.标准状况下,1 g H2和14 g N2的体积相同
B.1 mol氧含6.02×1023个O2分子
C.将15.6gNa2O2固体加入到足量水中,反应过程中转移电子总数为1.204×1023个
D.20g重水(D2O)中含有电子数为6.02×1024个
【答案】B
【解析】
A.标准状况下,1gH2的物质的量为![]() =0.5mol,14gN2的物质的量为
=0.5mol,14gN2的物质的量为![]() =0.5mol,则气体的物质的量相同时,其体积相同,故A正确;
=0.5mol,则气体的物质的量相同时,其体积相同,故A正确;
B.氧指代不明,若为1molO,则含3.01×1023个 O2,故B错误;
C.将15.6gNa2O2固体为0.2mol,加入到足量水中发生氧化还原反应生成氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,反应过程中2mol Na2O2转移2mol电子,则0.2mol Na2O2转移电子总数为0.2mol ×6.02×1023=1.204×1023个,故C正确;
D.20g重水(D2O)的物质的量是1mol,含有的电子数为10×6.02×1023=6.02×1024个,故D正确;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数![]() (X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是
(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是![]()
![]()
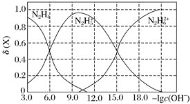
A.Kb1(N2H4)=10-6
B.反应![]() 的pK=9.0(已知:Pk=-lgK)
的pK=9.0(已知:Pk=-lgK)
C.N2H5Cl溶液中c(H+)>c(OH-)
D.N2H5Cl溶液中存在c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法,氨还可以进一步用来合成尿素、生产纯碱。
(1)写出氨分子的电子式______,其中氮原子有_____种能量不同的电子,氮原子的轨道表示式__________。
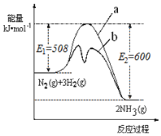
(2)根据如图提供的信息,写出该反应的热化学方程式___________________,右图的曲线中______(填“a”或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
(3)在恒容容器中,下列描述中能说明上述反应已达平衡的是______。
A 3v(H2)正=2v(NH3)逆
B 单位时间内生成nmolN2的同时生成2nmolNH3
C 容器内气体的密度不随时间的变化而变化
D 容器内压强不随时间的变化而变化
(4)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n(N2)/n(H2) | P(MPa) |
1 | 450 | 1/3 | 1 |
2 | ________ | 1/3 | 10 |
3 | 480 | _________ | 10 |
(5)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。图为合成塔中不同氨碳比a
CO(NH2)2(l)+H2O(g)。图为合成塔中不同氨碳比a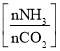 和水碳比b
和水碳比b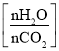 时二氧化碳转化率(α)。b宜控制在_______(填字母)范围内。
时二氧化碳转化率(α)。b宜控制在_______(填字母)范围内。
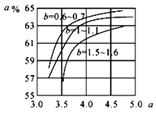
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.6 D. 1~1.6
a宜控制在4.0左右,理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。下图为一套浓差电池和电解质溶液再生的配套装置示意图,闭合开关K之前,两个Cu电极的质量相等。下列有关这套装置的说法中错误的是

A. 循环物质E为水
B. 乙池中Cu电极为阴极,发生还原反应
C. 甲池中的电极反应式为Cu2++2e-=Cu
D. 若外电路中通过1mol电子,两电极的质量差为64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解法制取 Na2FeO4 的装置图如图所示,下列说法正确的是(电解过程中温度保 持不变,溶液体积变化忽略不计)
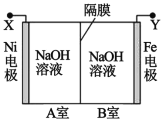
A.Y 是外接电源的正极,Fe 电极上发生还原反应
B.Ni 电极上发生的电极反应为:2H2O - 4e-== O2↑+4H+
C.若隔膜为阴离子交换膜,则电解过程中 OH-由 B 室进入 A 室
D.电解后,撤去隔膜,充分混合,电解液的 pH 比原来小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒及其化合物在工业上有许多用途。某钒精矿的主要成分及质量分数如下表:
物质 | V2O5 | V2O3 | K2O | SiO2 | Fe2O3 | Al2O3 |
质量分数% | 0.81 | 1.70 | 2.11 | 63.91 | 5.86 | 12.51 |
一种从该钒精矿中提取五氧化二钒的流程如下:
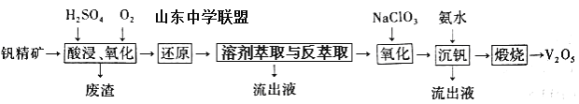
回答下列问题:
(1)“酸浸、氧化”时,V2O3转化为VO2+,反应的离子方程式为____________________________________;若用浓盐酸代替硫酸,V2O5转化为VO2+,同时生成有毒的黄绿色气体,反应的化学方程式为__________________。
(2)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用____________(填名称,下同)对浸出液进行“还原”处理。为检验“还原”后的滤液中是否含有Fe3+,可选用的化学试剂是____________________。
(3)“溶剂萃取与反萃取”可表示为:VO2+ + (HR2PO4)2(O)![]() VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
(4)“氧化”中,欲使3molVO2+变为VO2+,则需要氧化剂NaClO3至少为____________mol。
(5)单质钒可用于制造特种合金钢。以五氧化二钒和金属钙为原料在高温条件下可制备单质钒,表示制备过程的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,能达到相应实验目的的是
|
|
|
|
A.制备并收集乙酸乙酯 | B.证明氯化银溶解度大于硫化银 | C.验证溴乙烷的消去产物是乙烯 | D.推断S、C、Si的非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾的分类收集是实现垃圾处理无害化、减量化和资源化的重要措施。向贴有如下图所示标志的垃圾箱中丢弃的垃圾应是

A.厨房垃圾B.可回收垃圾C.有害垃圾D.其他垃圾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如图所示:
A 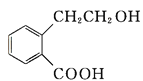 B
B 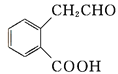 C
C 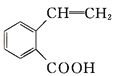 D
D 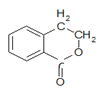
(1)A的分子式是______,B中的含氧官能团名称是______、________。
(2)A→B的反应类型是______;A—D中互为同分异构体的是______ (填代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com