
【题目】KH2PO4在农业上用作高效磷钾复合肥,在化学工业中还用作制偏磷酸钾的原料。一种电解法制备KH2PO4的装置如图所示。下列说法错误的是( )
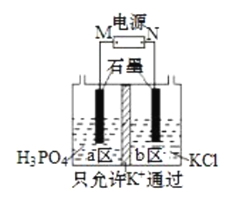
A.电源M极为负极,a区生成KH2PO4
B.b区电极反应为:4OH--4e-=O2↑+2H2O
C.电解过程中a区水的电离平衡正向移动
D.当0.1molK+通过离子交换膜时,阴阳两极产生的气体共2.24L(标准状况)
【答案】B
【解析】
a区含有磷酸,如生成KH2PO4,则应消耗氢离子,且钾离子进入a区,则a区为阴极,发生反应为2H++2e-=H2↑,b为阳极,发生2Cl--2e-=Cl2↑,M为负极,N为正极,以此解答该题。
A.由以上分析可知M为负极,a为阴极,生成KH2PO4,故A正确;
B.b区为阳极,发生氧化反应生成氯气,电极方程式为2Cl--2e-=Cl2↑,故B错误;
C.a区为阴极,氢离子浓度降低,对水的电离的抑制减小,则水的电离正向移动,故C正确;
D.当0.1mol K+通过离子交换膜时,则转移0.1mol电子,由电极方程式2H++2e-=H2↑、2Cl--2e-=Cl2↑可知两极各生成0.05mol气体,共0.1mol,体积为2.24L,故D正确。
故选:B。


科目:高中化学 来源: 题型:
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
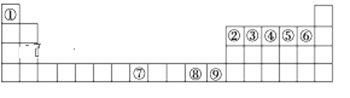
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,元素⑦位于周期表的___区。
(2)写出元素③与元素⑤形成的稳定化合物的结构式___________。
(3)②、⑥两元素形成的化合物的立体构型为_______,其中心原子的杂化轨道类型为______。
(4)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于_____晶体(填晶体类型)。
(5)⑧的二价阳离子与过量的④的简单氢化物的水溶液作用的离子方程式_________。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为____。
(7)将①、⑥形成的化合物溶于水,其中可能存在的氢键表示为_______(写一种即可)。
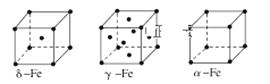
(8)金属⑦有δ、γ、α三种同素异形体,各晶胞如下图,则δ和α中原子的配位数之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有Cu、Fe、Al、Co、Li、Si等成分的某合金废料回收利用的工艺流程如图所示。

已知:
①Fe、Co在周期表中属同周期、同族;常温下,pH=7.3时Li+或Co3+开始沉淀。
②有关物质的溶度积(Ksp):
物质 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
Ksp | 4.0×10-21mol3·L-3 | 1.0×10-32mol4·L-4 | 1.0×10-38mol4·L-4 | 8.0×10-19mol3·L-3 |
回答下列问题
(1)Na2CO3溶液可作为合金废料的油污除剂,用离子方程式表示其原理__。
(2)“浸出渣”中的物质为__。
(3)①“浸出液”加入双氧水的作用是__(用离子方程式表示)。
②氨水的作用是调节溶液的pH,常温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol·L-1认为完全沉淀)。需调节溶液的pH范围为__。
(4)得到的CoC2O4·2H2O晶体在空气中充分焙烧可得Co2O3,化学方程式为__。
(5)已知Li2CO3微溶于水,其饱和溶液的浓度与温度的关系如表所示。
温度/℃ | 10 | 30 | 60 |
浓度/(mol·L-1) | 0.21 | 0.17 | 0.14 |
则操作X为蒸发浓缩、__,理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置可以进行实验并能达到实验目的的是
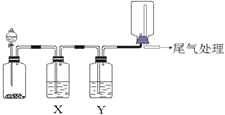
选项 | 实验目的 | X中试剂 | Y中试剂 |
A[] | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4 |
D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。
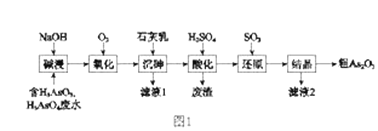
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
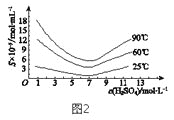
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。
(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+2B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.C的生成速率与C分解的速率相等
B.单位时间内生成nmol A,同时生成2nmol B
C.单位时间内消耗nmol A,同时生成2nmol C
D.B的生成速率与C分解的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物他莫肯芬(Tamoxifen)的一种合成路线如图所示:

已知:![]() +HBr
+HBr![]() +RBr
+RBr

回答下列问题。
(1)A+B→C的反应类型为__;C中官能团有醚键、__(填名称)。
(2)CH3CH2I的名称为__。
(3)反应D→E的化学方程式为__。
(4)Tamoxifen的结构简式为__。
(5)X是C的同分异构体。X在酸性条件下水解,生成2种核磁共振氢谱都显示4组峰的芳香族化合物,其中一种遇FeCl3溶液显紫色。X的结构简式为__、__(写2种)。
(6)设计用 和CH3I为原料(无机试剂任选)制备
和CH3I为原料(无机试剂任选)制备 的合成路线:__。
的合成路线:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1 mol/L NH4HSO4溶液,④0.1 mol/L (NH4)2SO4,⑤0.1 mol/L氨水。请根据要求填写下列空白:
(1)溶液①呈______性(填“酸”、“碱”或“中”),其原因是____________________(用离子方程式表示)。
(2)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是c(CH3COO-) ________c(NH4+)(填“>”、“<”或“=”)。
(3)上述溶液中c(NH4+)最小的是_________(填序号)。
(4)常温下,0.1 mol/ L氨水溶液加水稀释过程中,下列表达式的数值变大的是____________(填字母)。
A.c(OH—) B.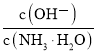
C.c(H+)·c(OH-) D.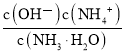
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com