
【题目】下列有关实验现象和解释或结论都一定正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 某钾盐溶于盐酸后,产生无色无味气体,将其通入澄清石灰水 | 有白色沉淀出现 | 该钾盐是 |
B | 将少量的溴水分别滴入 | 下层分别呈无色和紫红色 | 还原性: |
C | 将充满 | 红棕色变深 | 反应 |
D | 将 | 溶液变浑浊,继续通入该气体,浑浊消失 | 该溶液是 |
A.AB.BC.CD.D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.反应CaC2(s)+N2(g)=CaCN2(s)+C(s)能自发进行,则该反应ΔS>0
B.常温下向0.1 mol·L-1CH3COOH溶液中通入少量HCl气体,c(H+)·c(CH3COO-)增大
C.将1 mol Cl2溶于水中,反应中转移的电子数为6.02×1023个
D.2H2(g)+O2(g)=2H2O(g)的反应物键能总和大于生成物键能总和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新能源汽车所用蓄电池分为铅酸蓄电池、二次锂电池、空气电池等类型。请回答下列问题:
(1)2019年诺贝尔化学奖授予了为锂离子电池发展做出贡献的约翰·班宁斯特·古迪纳夫等三位科学家。如图所示为水溶液锂离子电池体系。放电时,电池的负极是_______(填a或b),溶液中Li+从______迁移(填“a向b”或“b向a”)。
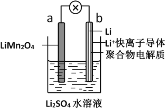
(2)铅酸蓄电池是最常见的二次电池,电压稳定,安全可靠,价格低廉,应用广泛。电池总反应为Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
①放电时,正极的电极反应式是________________________,电解质溶液中硫酸的浓度_____(填“增大”、“减小”或“不变”),当外电路通过0.5 mol e-时,理论上负极板的质量增加_______g。
②用该蓄电池作电源,进行粗铜(含Ag、Pt、Au等杂质)的电解精炼。如下图所示,电解液c选用________溶液,A电极的材料是_______,B电极反应式是_________。
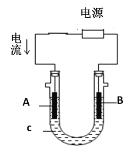
③用该蓄电池作电源,A、B为石墨电极,c为氯化钠溶液,进行电解。如上图所示,则A电极产生的气体是________,B电极附近溶液的pH_____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是( )
A.硅胶、生石灰、氯化钙等都是食品包装袋中常用的干燥剂
B.厕所清洁剂、食用醋、肥皂水、厨房清洁剂四种溶液的pH逐渐增大
C.酒精能使蛋白质变性,预防新冠肺炎病毒使用的酒精纯度越高越好
D.使用氯气对自来水消毒时,氯气会与自来水中的有机物反应,生成的有机氯化物可能对人有害
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,离子方程式书写正确的是( )
A.向NaHCO3溶液中加入NaOH溶液:HCO3-+OH-=CO2↑+H2O
B.0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH- =2BaSO4↓+AlO2-+2H2O
C.用醋酸除水垢:CaCO3+2H+=Ca2++H2O+CO2↑
D.硫酸溶液中滴加足量氢氧化钡溶液:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向某Na2CO3和NaHCO3的混合溶液中逐滴加入BaCl2溶液,溶液中lgc(Ba2+)与![]() 的变化关系如图所示。下列说法正确的是( )
的变化关系如图所示。下列说法正确的是( )
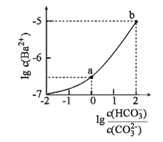
(已知:H2CO3的Ka1、Ka2分别为4.2×10-7、5.6×10-11)
A.a对应溶液的pH小于b
B.b对应溶液的c(H+)=4.2×10-7mol·L-1
C.a→b对应的溶液中![]() 减小
减小
D.a对应的溶液中一定存在:2c(Ba2+)+c(Na+)+c(H+)=3c(HCO3-)+c(Cl-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)Mo可被发烟硝酸及氢氟酸氧化为MoO2F2和MoOF4(少量),硝酸本身被还原为NO2,则该反应中氧化剂与还原剂的物质的量之比为_________。
(2)已知:2Mo(s)+3O2(g)=2MoO3(s) △H1;
2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H2;
MoS2(s)+2 O2(g)=Mo(s)+2SO2(g) △H3
则△H3=_________(用含△H1、△H2的代数式表示)
(3)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-
①辉钼矿应放入电解槽的_________(填“阴极区”或“阳极区”)。
②阴极的电极反应式为___________________________。
(4)碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2(s)+4H2(g)+2Na2CO3(s) ![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
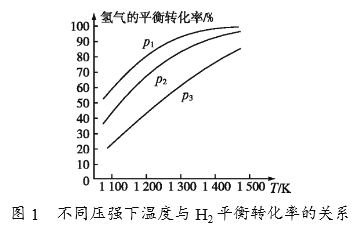
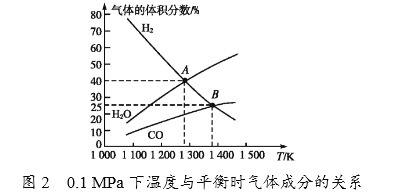
①由图1可知,该反应△H______(填“>”或“<”)0,p1、p2、p3由大到小的顺序为_______________________。
②由图2可知,A点时H2的平衡转化率为____________。
③B点对应的平衡常数K=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(MPa)2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1)。
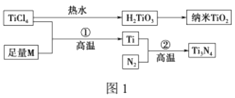
图中的M是短周期金属元素,M的部分电离能如表:
I1 | I2 | I3 | I4 | I5 | |
电离能/(kJ/mol) | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为________________。
(2)M是________(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为____。
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中采取sp2方式杂化的碳原子有________个,化合物乙中采取sp3方式杂化的原子3对应的元素的电负性由大到小的顺序为________________。
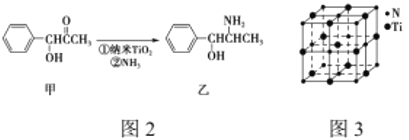
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为________________g/cm3 (NA为阿伏加德罗常数的值,只列计算式)。该晶体中与氮原子距离相等且最近的氮原子有________个。
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据:
离子晶体 | NaCl | KCl | CaO |
晶格能/(kJ/mol) | 786 | 715 | 3401 |
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com