
【题目】新能源汽车所用蓄电池分为铅酸蓄电池、二次锂电池、空气电池等类型。请回答下列问题:
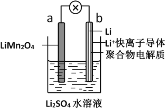
(1)2019年诺贝尔化学奖授予了为锂离子电池发展做出贡献的约翰·班宁斯特·古迪纳夫等三位科学家。如图所示为水溶液锂离子电池体系。放电时,电池的负极是_______(填a或b),溶液中Li+从______迁移(填“a向b”或“b向a”)。
(2)铅酸蓄电池是最常见的二次电池,电压稳定,安全可靠,价格低廉,应用广泛。电池总反应为Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
①放电时,正极的电极反应式是________________________,电解质溶液中硫酸的浓度_____(填“增大”、“减小”或“不变”),当外电路通过0.5 mol e-时,理论上负极板的质量增加_______g。
②用该蓄电池作电源,进行粗铜(含Ag、Pt、Au等杂质)的电解精炼。如下图所示,电解液c选用________溶液,A电极的材料是_______,B电极反应式是_________。
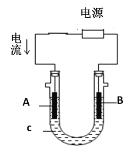
③用该蓄电池作电源,A、B为石墨电极,c为氯化钠溶液,进行电解。如上图所示,则A电极产生的气体是________,B电极附近溶液的pH_____(填“增大”、“减小”或“不变”)。
【答案】b b向a PbO2+2e-+4H++2SO42-═PbSO4+2H2O 减小 24 CuSO4(CuCl2等) 粗铜 Cu2++2e-=Cu 氯气 增大
【解析】
(1)由题给装置图可知,锂电极为原电池的负极,放电时,溶液中阳离子由负极向正极迁移;
(2)①由电池总反应式可知,Pb电极是负极,Pb失电子发生氧化反应,PbO2是正极,PbO2得电子发生还原反应;
②电解精炼铜时,粗铜应作阳极,精铜作阴极;
③接通电路后,该装置为电解池,由题给装置图可知,电流流入的A电极为阳极,B电极为阴极。
(1)由题给装置图可知,b电极为原电池的负极,a电极为原电池的正极,放电时,溶液中Li+由负极向正极迁移,即从b向a迁移,故答案为:b;b向a;
(2)①由电池总反应式可知,Pb电极是负极,Pb失电子发生氧化反应,电极反应式为Pb-2e-+SO42-═PbSO4,PbO2是正极,PbO2得电子发生还原反应,电极反应式是PbO2+2e-+4H++2SO42-═PbSO4+2H2O;放电时,消耗H2SO4,则电解液中H2SO4的浓度将减少;当外电路通过0.5mol电子时,依据电子守恒计算理论上负极板的质量增加0.25mol×303g/mol-0.25mol×207g/mol=24g,故答案为:PbO2+2e-+4H++2SO42-═PbSO4+2H2O;减小;24;
②电解精炼铜时,粗铜应作阳极,精铜作阴极,由题给装置图可知,电流流入的A电极为粗铜精炼的阳极,B电极为阴极,则A电极为粗铜,B电极为精铜,电解液为可溶性铜盐,如硫酸铜或氯化铜等,阴极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故答案为:CuSO4(CuCl2等);粗铜;Cu2++2e-=Cu;
③接通电路后,该装置为电解池,由题给装置图可知,电流流入的A电极为阳极,B电极为阴极,氯离子在阳极上失电子发生氧化反应生成氯气,水电离出的氢离子在阴极上得电子发生还原反应生成氢气,破坏水的电离平衡,使阴极区云集大量氢氧根离子,使溶液呈碱性,故答案为:氯气;增大。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A.苯和氯气生成C6H6Cl6的反应是取代反应
B.可以用溴水鉴别苯和四氯化碳溶液
C.等物质的量的甲烷与氯气反应,有机产物只有CH3Cl
D.1mol![]() 最多可与4molH2发生加成
最多可与4molH2发生加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种杀菌效率高、二次污染小的水处理剂。实验室可通过反应制得
是一种杀菌效率高、二次污染小的水处理剂。实验室可通过反应制得![]() :
:![]() 。下列说法正确的是
。下列说法正确的是
A.氧化产物为![]() B.
B.![]() 在反应中失去电子
在反应中失去电子
C.氧化剂与还原剂的物质的量之比为1∶2D.1mol![]() 参加反应有2mol电子转移
参加反应有2mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】杂志Joule中题为“Li—CO2 Electrochemistry:A New Strategy for CO2 Fixation and Energy Storage”的文章,阐述关于电化学技术固定CO2新的反应途径。下图是采用新能源储能器件将CO2转化为固体产物,实现CO2的固定和储能灵活应用的装置。储能器件使用的Li—CO2电池组成为钌电极/CO2—饱和LiClO4—DMSO电解液/锂片。下列说法错误的是
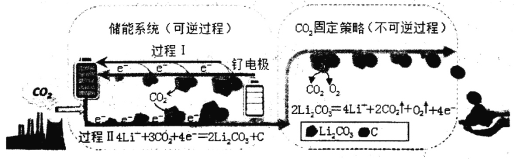
A.钌电极为负极,其电极反应式为:2Li2CO3+C—4e-=== 3CO2+4Li+
B.Li—CO2电池电解液由LiClO4—DMSO溶于水得到
C.这种电化学转化方式不仅减少CO2的排放,还可将CO2作为可再生能源载体
D.CO2的固定中,每生成1.5mol气体,可转移2mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.10mol·L-1的H2C2O4(二元弱酸)溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法不正确的是

A. 25℃时H2C2O4的一级电离常数为Ka1=104.3
B. pH=2.7的溶液中:c(H2C2O4)=c(C2O42-)
C. pH=7的溶液中:c(Na+)>2c(C2O42-)
D. 滴加NaOH溶液的过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液,实验尚缺少的玻璃用品是___________、___________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒___________(填“能”或“否”),其
原因是 。
(3)他们记录的实验数据如下:

已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表ΔH=_____________。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果__________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果____________(填“有”或“无”)影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA溶液所得滴定曲线如图。下列说法不正确的是

A.HA的电离平衡常数Ka=10-5
B.点①所示的溶液中:2c(Na+)=c(A-)+c(HA)
C.点③所示的溶液中:c(HA)>c(OH-)-c(H+)
D.点④所示的溶液中:2c(OH-)-2c(H+)=c(A-)+3c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都一定正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 某钾盐溶于盐酸后,产生无色无味气体,将其通入澄清石灰水 | 有白色沉淀出现 | 该钾盐是 |
B | 将少量的溴水分别滴入 | 下层分别呈无色和紫红色 | 还原性: |
C | 将充满 | 红棕色变深 | 反应 |
D | 将 | 溶液变浑浊,继续通入该气体,浑浊消失 | 该溶液是 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(g)+nB(g)=eC(g)+fD(s) △H。若按反应物的化学计量数比投料,在一定条件下进行反应,该反应达到平衡时C的气体体积分数与温度、压强的关系如图所示。下列叙述正确的是
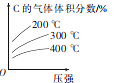
A.该反应的△H >0
B.该化学方程式中m+n>e+f
C.加入催化剂可加快正反应速率,逆反应速率不变
D.往平衡后的恒压容器中再充入一定量C,达到新平衡时,C的浓度与原平衡时的相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com