
【题目】常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA溶液所得滴定曲线如图。下列说法不正确的是

A.HA的电离平衡常数Ka=10-5
B.点①所示的溶液中:2c(Na+)=c(A-)+c(HA)
C.点③所示的溶液中:c(HA)>c(OH-)-c(H+)
D.点④所示的溶液中:2c(OH-)-2c(H+)=c(A-)+3c(HA)
【答案】C
【解析】
A. HA的电离平衡常数Ka=![]() =10-5,A正确;
=10-5,A正确;
B. 点①所示的溶液,n(NaA)=n(HA),2n(Na+)= n(A-)+ n(HA),所以2c(Na+)=c(A-)+c(HA),B正确;
C. 点③所示的溶液中,HA与NaOH刚好完全反应,此时溶质为NaA在溶液中存在以下两个平衡:A-+H2O![]() HA+OH- ,H2O
HA+OH- ,H2O![]() H++OH-,c(HA)=c(OH-)-c(H+),C错误;
H++OH-,c(HA)=c(OH-)-c(H+),C错误;
D. 点④所示的溶液中n(NaA)=0.002mol,n(NaOH)=0.001mol,溶液中存在以下两个平衡:
A-+H2O![]() HA+OH- H2O
HA+OH- H2O![]() H++OH-
H++OH-
0.002-x x 0.001+x y y
2n(OH-)-2n(H+)=0.002+2x
n(A-)+3n(HA)=0.002-x+3x=0.002+2x
同一混合溶液,体积相同,所以有2c(OH-)-2c(H+)=c(A-)+3c(HA),D正确。
故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是
A. 苯与液溴的反应:![]()
B. 2-丙醇的催化氧化反应:2CH3CH(OH)CH3 + O2 ![]() 2CH3CH2CHO + 2H2O
2CH3CH2CHO + 2H2O
C. 邻羟基苯甲酸与足量的NaHCO3溶液反应:![]() +2NaHCO3
+2NaHCO3![]()
![]() +2CO2↑+2H2O
+2CO2↑+2H2O
D. 实验室制取乙炔的反应:CaC2+2H2O → Ca(OH)2 + CH≡CH↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是
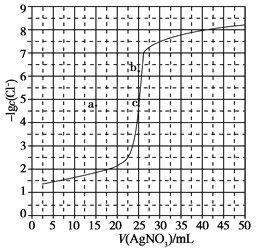
A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是有关物质的Ksp:
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
Ksp(单位省略) | 2.8×10-9 | 6.8×10-6 | 4.7×10-6 | 5.6×10-12 |
回答下列问题:
(1)___(填“能”或“不能”)直接把贝壳研磨成粉末撒入海水中,使Mg2+转化为MgCO3沉淀,原因是_______。
(2)实际生产中是把Mg2+转化为Mg(OH)2沉淀,而不是转化为MgCO3沉淀,原因是______,请你推测应将贝壳进行怎样的加工处理_____。
(3)某同学在实验室条件下模拟该生产过程,在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他_____(填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是__________。
(4)要制得无水MgCl2,过滤出Mg(OH)2沉淀后,用试剂_____(填化学式)将其溶解,选择该试剂的理由是__________。
(5)将得到的氯化镁溶液在浓缩池中制得MgCl2·6H2O。然后将MgCl2·6H2O转移到干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O,才能得到无水MgCl2,原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=11的NaOH溶液和CH3COONa溶液各5 mL,分别稀释至500mL,溶液的pH与溶液体积(V)的关系如图所示,下列说法正确的是

A. a>9
B. 稀释后的溶液耗酸量相等
C. 曲线y表示NaOH溶液的变化
D. N、P、M点对应的溶液中水的电离程度依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L-1 NaOH溶液滴定10 mL 0.1 mol·L-1 H2X溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是

A.水电离出来的c(OH-):D点>B点
B.C点存在关系式:c(Na+)=c(HX-)+c(X2-)-c(H+)
C.B点:c(HX-)>c(H+)>c(X2-)>c(H2X)
D.A点溶液中加入少量水:![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法不正确的是(NA为阿伏加德罗常数的值)
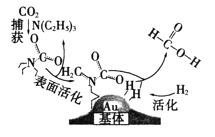
A.10.1gN(C2H5)3中所含的共价键数目为2.1NA
B.标准状况下,22.4LCO2中所含的电子数目为16NA
C.在捕获过程中,二氧化碳分子中的共价键完全断裂
D.100g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含CH3COOH和CH3COO-的溶液中, CH3COOH、CH3COO-二者中各自所占的物质的量分数(a)随溶液pH变化的关系如图所示。

下列说法不正确的是
A. 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH)
B. 在pH=7的溶液中,a(CH3COOH)=0,a(CH3COO-)=1.0
C. 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D. 在pH=4.76的溶液中加盐酸,a(CH3COOH)与a(CH3COO-)之和保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com