
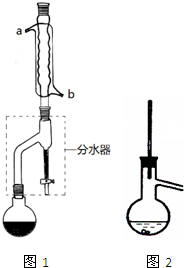
 乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室制备乙酸正丁酯的化学方程式为:
乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室制备乙酸正丁酯的化学方程式为:| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/g?mL-1 | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
| 浓H2SO4 |
| △ |
| 74×1.98g |
| 18 |
| 8.14g |
| 9.3g |


科目:高中化学 来源: 题型:
| A、NaA溶液中c(Na+)-c(A-)=10-6mol?L-1 |
| B、NaB溶液中c(H+)+c(HB)=10-2mol?L-1 |
| C、将两溶液混合,混合溶液中:c(OH-)>5×10-3mol?L-1 |
| D、两溶液中的离子总数不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
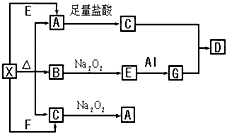 如图表示的反应关系中,部分产物被略去.已知2mol白色固体粉末X受热分解,恢复到室温生成白色固体A、无色液体B、无色气体C各1mol.X、E、G的焰色反应均为黄色.回答下列问题:
如图表示的反应关系中,部分产物被略去.已知2mol白色固体粉末X受热分解,恢复到室温生成白色固体A、无色液体B、无色气体C各1mol.X、E、G的焰色反应均为黄色.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、实验①可用于制取氨气 |
| B、实验②中最后一滴NaOH标准液使溶液由无色变为红色,即达到滴定终点 |
| C、装置③可用于吸收尾气中少量NH3或HCl,并防止倒吸 |
| D、装置④可用于从酒精水溶液中制取无水乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
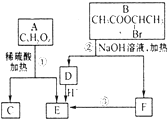 已知当一个碳原子上连有两个羟基时,易发生下列转化:
已知当一个碳原子上连有两个羟基时,易发生下列转化: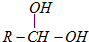
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂是多种高级脂肪酸的甘油酯,要合理摄入 |
| B、乙酸乙酯和高级脂肪酸甘油酯都能与氢氧化钠溶液发生反应,都有酸性 |
| C、植物油能使酸性高锰酸钾溶液褪色 |
| D、油脂的水解反应是取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| [OH-] |
| [NH3?H2O] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com