
【题目】生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应)。
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在。
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化。
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)。
实验序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
③ | ________ | 7 | 60 | ______ | ______ | 10 |
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示。
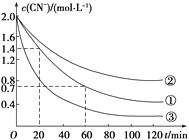
(2)实验①中20~60 min时间段反应速率:v(CN-)=______mol·L-1·min-1。
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是____________________(填一点即可)。在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO,同时放出NH3,试写出该反应的离子方程式:____________。
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他们设计实验并验证上述结论,完成下表中内容(已知:废水中的CN-浓度可用离子色谱仪测定) ______。
实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
【答案】 双氧水的浓度对破氰反应速率的影响 10 20 0.017 5 初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化) CN-+H2O2+H2O===NH3↑+HCO
实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 相同时间内,若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用;若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
【解析】(1)影响该反应的因素有pH以及双氧水的浓度,实验目的为废水的初始pH对破氰反应速率的影响和双氧水的浓度对破氰反应速率的影响,其他量应不变,而且总体积不变,所以CuSO4溶液的体积为10 mL,双氧水的体积为20 mL。(2)根据图像可知实验①中20~60 min时间段反应速率v(CN-)=![]() =0.017 5 mol·L-1·min-1。(3)pH越大,[Fe(CN)6]3-越稳定,越难被氧化,所以破氰反应速率减小;因为氰废水中的CN一最终被双氧水氧化为HCO3-,其中的碳由+2价变成+4价,1 mol CN-反应转移2 mol的电子,而1 mol过氧化氢得到2 mol的电子,所以CN一和H2O2的物质的量之比为1∶1,因此反应的离子方程式为CN-+H2O2+H2O===NH3↑+HCO3-。(4)要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,其它条件应该是相同的,因此实验方案为:分别取温度相同、体积、浓度相同的含氰废水的试样两等份,滴加过氧化氢,一份中加入少量的无水硫酸铜粉末,另一份不加,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度,如果在相同时间内,甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用,反之则不起催化作用。
=0.017 5 mol·L-1·min-1。(3)pH越大,[Fe(CN)6]3-越稳定,越难被氧化,所以破氰反应速率减小;因为氰废水中的CN一最终被双氧水氧化为HCO3-,其中的碳由+2价变成+4价,1 mol CN-反应转移2 mol的电子,而1 mol过氧化氢得到2 mol的电子,所以CN一和H2O2的物质的量之比为1∶1,因此反应的离子方程式为CN-+H2O2+H2O===NH3↑+HCO3-。(4)要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,其它条件应该是相同的,因此实验方案为:分别取温度相同、体积、浓度相同的含氰废水的试样两等份,滴加过氧化氢,一份中加入少量的无水硫酸铜粉末,另一份不加,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度,如果在相同时间内,甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用,反之则不起催化作用。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计实验验证以下规律:元素的非金属性越强,对应的最高价氧化物的水化物酸性就越强。该小组设计了如图装置进行实验。拟比较C、Si、S三种元素的非金属性。
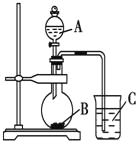
(1)推测三种元素对应的最高价氧化物的水化物酸性由强到弱的顺序是_________________(填化学式)。
(2)若B、C均为正盐,且焰色反应均为黄色。A、B、C的化学式依次为_________、__________、_________(A、C填溶质的化学式)。
(3)烧瓶中的实验现象为________________________________。
(4)固体B也可以用B的溶液代替。实验室配制0.1mol/L的B的溶液450mL,需要用托盘天平称取B_____g。
(5)有同学认为,将A中物质换为浓硝酸,其余试剂不变。则可以验证N、C、Si三元素的非金属性强弱。你认为,该同学的观点___________(选填“正确”“错误”)。理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中不正确的是( )
A.工业上可利用海水制取镁
B.从海产品(如海带等)中提取碘是工业上获取碘的重要途径
C.工业上可通过铝土矿获得铝
D.工业上用CO氧化赤铁矿(含Fe2O3)获得铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V2﹣、W3﹣、X2+、Y2﹣、Z﹣是由短周期元素形成的简单离子,其中V2﹣、W3﹣、X2+均是10电子的微粒,Y2﹣、Z﹣与Ar原子具有相同的电子数。(请用化学用语回答下列问题)
(1)V2﹣的离子结构示意图为_________________。
(2)V、W、X的原子半径由小到大的顺序是________________。
(3)元素Y、Z气态氢化物的热稳定性比较(填化学式):______________。
(4)将Z的单质通入石蕊溶液中发生的颜色变化如下图,请在方框内填写出导致该阶段颜色变化的主要粒子符号。________、________、________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 混溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的
混溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的![]()
A. 加入 KSCN的溶液一定不变红色B. 溶液中一定含有![]()
C. 溶液中可能含![]() D. 剩余固体中一定有铜
D. 剩余固体中一定有铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验操作及现象均正确的是![]()
A. 实验Ⅰ:产生红褐色沉淀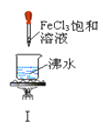
B. 实验Ⅱ:溶液颜色变红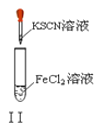
C. 实验Ⅲ:放出大量气体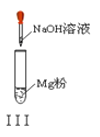
D. 实验Ⅳ:先出现白色沉淀,后溶解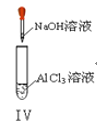
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一化学反应中,反应物B的浓度在5 s内从2.0 mol/L变成0.5 mol/L,在这5 s内B的化学反应速率为
A. 0.3B. 0.3 mol/(L·s)
C. 0.4 mol(L·s)-1D. 0.04 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是周期表中短周期的一部分。已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是
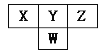
A. 原子半径的大小顺序是W>Y>ZB. X的氢化物没有Z的氢化物稳定
C. 常见的X的氢化物具有正四面体结构D. Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com