
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s) + CO2(g) = 2Fe3O4(s) + C(s) △H= —76.0kJ/mol
C(s) + 2H2O(g) = CO2(g) + 2H2(g) △H= + 113.4kJ/mol
写出FeO(s)和H2O(g)生成Fe3O4(s)和H2(g)的热化学方程式________。
(2)如图为1 mol NO2(g)和1 mol CO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图。已知E1=134 kJ·mol-1,E2=368 kJ·mol-1(E1、E2为反应的活化能)。

若在反应体系中加入催化剂,反应速率增大,则E1、ΔH的变化分别是________、________(填“增大”、“减小”或“不变”);该反应放出的热量为__________kJ。
(3)若反应SO2(g)+I2(g)+2H2O(g) ═ H2SO4(l)+2HI(g)在150 ℃下能自发进行,则ΔH____________ 0 (填“大于”、“ 小于”或“大于或小于都可”)。
【答案】3FeO(s) + H2O(g) = Fe3O4(s) + H2(g) △H= + 18.7.4kJ/mol 减小 不变 234 小于
【解析】
(1)FeO与H2O反应的方程式为3FeO+H2O=Fe3O4+H2,①6FeO(s) + CO2(g) = 2Fe3O4(s) + C(s),②C(s) + 2H2O(g) = CO2(g) + 2H2(g) ,根据目标反应方程式,(①+②)/2,得出△H=(-76.0+113.4)/2kJ·mol-1=+18.7kJ·mol-1,热化学反应方程式为 3FeO(s) + H2O(g) = Fe3O4(s) + H2(g) △H= + 18.7.4kJ·mol-1;
(2)使用催化剂,降低活化能,即E1减小,△H只与始态和终态有关,即使用催化剂,△H不变;根据图像该反应放出的热量为(E2-E1)kJ=(368-134)kJ=234kJ;
(3)根据复合判据,能自发进行△G<0,根据反应方程式,该反应为熵减反应,即△S<0,推出△H<0。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】用0.2000 mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000 mol/L的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“ 0”或“0”刻度线稍下,并记下读数;④量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴甲基橙溶液;⑤用标准液滴定至终点,记下滴定管液面读数。⑥重复以上滴定操作2-3次。请回答:
(1)以上步骤有错误的是(填编号)____________________
(2)步骤④中,量取20.00 mL待测液应使用_________________(填仪器名称)
(3)步骤⑤滴定时眼睛应注视______________________________;判断到达滴定终点的依据是:______________________________________。
(4)以下是实验数据记录表
滴定 次数 | 盐酸体积 (mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.10 |
2 | 20.00 | 0.00 | 16.20 |
3 | 20.00 | 0.00 | 16.16 |
从表中可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是__________
A. 锥形瓶装液前,留有少量蒸馏水 B. 滴定结束时,仰视读数
C.滴定前滴定管尖嘴无气泡,滴定结束有气泡 D.锥形瓶用待测液润洗
E. NaOH标准液保存时间过长,有部分变质
(5)根据表中记录数据,通过计算可得,该盐酸浓度为: ____________mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6 g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入22.4 L的CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:

CH3CH2CH2CH2OH![]() CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为___________________________。
(2)加入沸石的作用是________________________________________________。
若加热后发现未加沸石,应采取的正确方法是______________________________。
(3)上述装置图中,D仪器的名称是________,E仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______________层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是__________________________________、__________________________________________________。
(7)本实验中,正丁醛的产率为________%(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中发生反应:xA(g) +B(g)![]() 2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是
2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是

A. x=1
B. 反应进行到1min时,反应体系达到化学平衡状态
C. 2min后,A的正反应速率一定等于C的逆反应速率
D. 2min后,容器中A与B的物质的量之比一定为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素![]() 的原子序数依次增大。
的原子序数依次增大。![]() 是由这些元素组成的二元化合物,常温常压下
是由这些元素组成的二元化合物,常温常压下![]() 为液体,其余均为无色气体。
为液体,其余均为无色气体。![]() 的摩尔质量为
的摩尔质量为![]() 的2倍,
的2倍,![]() 是元素
是元素![]() 的单质,是绿色植物光合作用产生的无色气体,
的单质,是绿色植物光合作用产生的无色气体,![]() 物质能使湿润的红色石蕊试纸变蓝,
物质能使湿润的红色石蕊试纸变蓝,![]() 能使品红溶液褪色。上述物质的转化关系如图所示。下列说法正确的是
能使品红溶液褪色。上述物质的转化关系如图所示。下列说法正确的是

A. ![]() 与
与![]() 均为酸性氧化物B.
均为酸性氧化物B. ![]() 的含氧酸是一种强酸
的含氧酸是一种强酸
C. 沸点:![]() D. 原子半径:
D. 原子半径:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取氢氧化钠的工艺流程示意图如下:
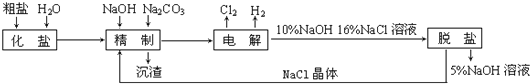
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为_______________________,与电源负极相连的电极附近,溶液pH值_____________(选填:不变、升高或下降)
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为_______________________,_______________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是___________(选填a、b、c,多选扣分)
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为____________(选填a,b,c多选扣分)
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__________、冷却、___________(填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和![]() ,相应的化学方程式为______________________。
,相应的化学方程式为______________________。
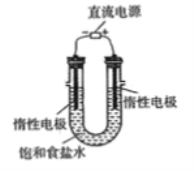
(7)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2____________(填“>”、“=”或“<”)2L,原因是_____________________。
(8)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4→ZnSO4+H2↑、MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
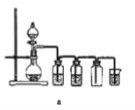
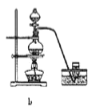
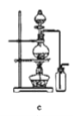
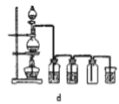
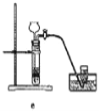
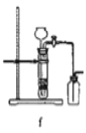
据此,制备并收集干燥、纯净Cl2的装置是______(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图装置可以制备四氯化锡(部分夹持装置已略去)。

有关信息如下表:
化学式 |
|
|
摩尔质量( | 190 | 261 |
熔点 | 246 | -33 |
沸点 | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)装置甲中仪器![]() 的名称为_____________。
的名称为_____________。
(2)用装置甲制取氯气,![]() 被还原为
被还原为![]() ,该反应的离子方程式为___________。
,该反应的离子方程式为___________。
(3)将如图装置连接好,先检查装置气密性,再慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热装置丁,锡熔化后适当增大氯气流量,继续加热装置丁,此时继续加热装置丁的目的是:①促进氯气与锡反应;②_________________________。
(4)如果缺少装置乙,可能发生的副反应的化学方程式为_______________;装置己的作用是______(填字母代号)。
A.除去未反应的氯气,防止污染空气
B.防止空气中![]() 气体进入装置戊
气体进入装置戊
C.防止水蒸气进入装置戊的试管中使产物水解
D.防止空气中![]() 进入装置戊的试管中使产物氧化
进入装置戊的试管中使产物氧化
(5)某同学认为丁装置中的反应可能产生![]() 杂质,以下试剂中可用于检测是否产生
杂质,以下试剂中可用于检测是否产生![]() 的是______(填字母代号)。
的是______(填字母代号)。
A. ![]() 溶液 B.
溶液 B. ![]() 溶液(滴有
溶液(滴有![]() 溶液) C.
溶液) C. ![]() 溶液
溶液
(6)反应中用去锡粒![]() ,反应后在戊装置的试管中收集到
,反应后在戊装置的试管中收集到![]() ,则
,则![]() 的产率为_____(保留3位有效数字)。
的产率为_____(保留3位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com