
【题目】氯碱厂电解饱和食盐水制取氢氧化钠的工艺流程示意图如下:
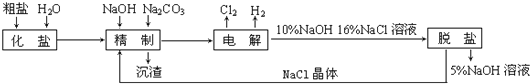
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为_______________________,与电源负极相连的电极附近,溶液pH值_____________(选填:不变、升高或下降)
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为_______________________,_______________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是___________(选填a、b、c,多选扣分)
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为____________(选填a,b,c多选扣分)
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__________、冷却、___________(填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和![]() ,相应的化学方程式为______________________。
,相应的化学方程式为______________________。
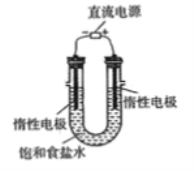
(7)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2____________(填“>”、“=”或“<”)2L,原因是_____________________。
(8)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4→ZnSO4+H2↑、MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
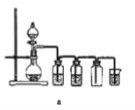
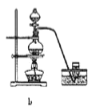
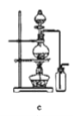
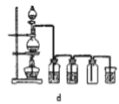
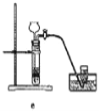
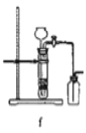
据此,制备并收集干燥、纯净Cl2的装置是______(填代号)。
【答案】2Cl--2e-=Cl2↑ 升高 Ca2++CO32-=CaCO3↓ Mg2++2OH-=Mg(OH)2↓ ac bc 蒸发 过滤 NaCl+H2O ![]() NaClO+H2↑ < 产物氯气会与氢氧化钠反应 d
NaClO+H2↑ < 产物氯气会与氢氧化钠反应 d
【解析】
工业食盐含Ca2+、Mg2+等杂质,由流程可知,粗盐加水化盐溶解后,加NaOH除去镁离子,加碳酸钠除去钙离子,精制后得到的沉渣为CaCO3、Mg(OH)2;精制后的食盐水电解生成NaOH、氢气、氯气,最后脱盐(NaCl等)得到高浓度的NaOH溶液和氯化钠晶体,氯化钠晶体可以用于精制过程,据此分析解答(1)~(7);
(8)利用二氧化锰和浓盐酸加热来获得氯气,制得的氯气中会含有氯化氢和水蒸气,据此分析判断。
(1)与电源正极相连的电极为电解池的阳极,发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,与电源负极相连的电极为电解池的阴极,发生还原反应,电极反应式为H2O+2e-=H2↑+2OH-,,生成了氢氧根离子,溶液的碱性增强,溶液的pH升高,故答案为:2Cl--2e-=Cl2↑;升高;
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中加NaOH除去镁离子,加碳酸钠除去钙离子,发生反应的离子方程式为:Ca2++CO32-=CaCO3↓、Mg2++OH-=Mg (OH)2↓,故答案为:Ca2++CO32-=CaCO3↓;Mg2++OH-=Mg (OH)2↓;
(3)除去硫酸根离子的同时不能引入新的离子,而氯离子和氢氧根离子原溶液中本身就含有,故钡试剂可以是Ba(OH)2或BaCl2,故答案为:ac;
(4)加入的过量的钡离子可以由碳酸钠除去,故碳酸钠需要在钡试剂之后加入,钡试剂与氢氧化钠先后都可,故加入试剂的顺序为先加NaOH,后加钡试剂,再加Na2CO3或先加钡试剂,后加NaOH,再加Na2CO3,故答案为:bc;
(5)NaOH的溶解度随温度的升高而变大,NaCl的溶解度随温度的升高基本不变,利用溶解度差异可以除去NaCl,步骤一般为蒸发浓缩、冷却结晶、过滤,故答案为:蒸发;过滤;
(6)电解饱和食盐水,阳极:2Cl--2e-=Cl2↑,阴极:H2O+2e-=H2↑+2OH-,Cl2与NaOH充分接触,采用无隔膜电解冷的食盐水时,产物仅是NaClO和H2,反应的化学方程式为:NaCl+H2O![]() NaClO+H2↑,故答案为:NaCl+H2O
NaClO+H2↑,故答案为:NaCl+H2O![]() NaClO+H2↑;
NaClO+H2↑;
(7)电解饱和食盐水中若收集的H2为2L,产物 Cl2 会与 NaOH反应,则同样条件下收集的Cl2 <2L,故答案为:<;产物Cl2会与NaOH反应;
(8)实验室利用二氧化锰和浓盐酸加热来获得氯气,属于加热固体和液体生成气体的反应,其中的杂质氯化氢可以加饱和食盐水来除,杂质水蒸气可以采用浓硫酸来除去,故选装置d,故答案为:d。


科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为![]() )为原料制备氯化铁晶体(
)为原料制备氯化铁晶体(![]() )的工艺流程如下所示:
)的工艺流程如下所示:

下列说法不正确的是
A. “酸溶”过程中使用的酸也可以是硝酸
B. 为防止污染,“焙烧”过程中产生的![]() 应回收利用
应回收利用
C. 通入氯气的目的是氧化![]()
D. 用![]() 制取无水
制取无水![]() 时,需要在氯化氢气流中加热
时,需要在氯化氢气流中加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s) + CO2(g) = 2Fe3O4(s) + C(s) △H= —76.0kJ/mol
C(s) + 2H2O(g) = CO2(g) + 2H2(g) △H= + 113.4kJ/mol
写出FeO(s)和H2O(g)生成Fe3O4(s)和H2(g)的热化学方程式________。
(2)如图为1 mol NO2(g)和1 mol CO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图。已知E1=134 kJ·mol-1,E2=368 kJ·mol-1(E1、E2为反应的活化能)。

若在反应体系中加入催化剂,反应速率增大,则E1、ΔH的变化分别是________、________(填“增大”、“减小”或“不变”);该反应放出的热量为__________kJ。
(3)若反应SO2(g)+I2(g)+2H2O(g) ═ H2SO4(l)+2HI(g)在150 ℃下能自发进行,则ΔH____________ 0 (填“大于”、“ 小于”或“大于或小于都可”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述正确的是( )
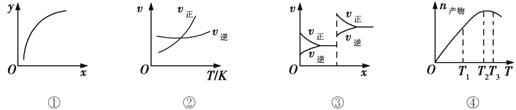
A. 图①表示在恒容容器中MgSO4(s) + CO(g)![]() MgO(s) + CO2(g) + SO2(g),横坐标代表硫酸镁的质量,纵坐标可代表CO的转化率
MgO(s) + CO2(g) + SO2(g),横坐标代表硫酸镁的质量,纵坐标可代表CO的转化率
B. 图②表示其他条件一定时,反应A(g)+3B(g)![]() 2C(g)的反应速率随温度变化的图像,正反应ΔH>0
2C(g)的反应速率随温度变化的图像,正反应ΔH>0
C. 图③对应的反应一定是非等体积反应加压后平衡移动的变化情况
D. 恒压密闭容器中加入一定量A、B,发生反应A(g)+3B(g)![]() 2C(g),图④表示反应过程中不断升高温度,产物C物质的量变化规律,则正反应方向吸热
2C(g),图④表示反应过程中不断升高温度,产物C物质的量变化规律,则正反应方向吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积,不同浓度的NaCl、MgCl2、AlCl3三种溶液分别与等体积等物质和量浓度的AgNO3溶液恰好完全反应,则NaCl、MgCl2、AlCl3三种溶液中Cl-的物质的量浓度之比是
A.1:2:3B.3:2:1C.6:3:2D.1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物![]()
![]() 的说法正确的是
的说法正确的是
A. a、b互为同系物
B. c中所有碳原子可能处于同一平面
C. a、b、c均能使酸性高锰酸钾溶液褪色
D. b的同分异构体中含有羧基的结构还有7种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量的甲苯加到汽油中可以改善汽油的抗爆性能。如果要使甲苯完全燃烧,甲苯蒸气与空气的体积比应该约为
A. 1:9 B. 1:11 C.1:26 D. 1:45
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)是一种重要的化工试剂,遇水剧烈水解。实验室可由氮气和钙加热制得氮化钙,实验装置如下图(省略部分固定装置)。

(1)氮化钙中所含的化学键有(填“共价键”或“离子键”)_________。
(2)球形干燥管中的干燥剂可选用(至少写一种)_________,结合化学方程式解释其作用_________。
(3)制备过程中末端导管必须始终插入试管A的水中,目的是①便于观察N2的流速;②_________。
(4)制备氮化钙的操作步骤:①按图示连接好实验装置;②_________;③打开活塞K并通入N2;④点燃酒精灯,进行反应;⑤反应结束后,熄灭酒精灯,继续通N2,使装置冷却至室温;⑥拆除装置,取出产物。
(5)上述步骤中③和④_________(填“能”或“不能”)交换,理由是_________。
(6)氮气不足会影响实验制得Ca3N2的纯度。为测定氮化钙的纯度,实验结束后取一定量的固体混合物于足量水中,微热使气体完全逸出,收集到气体共6.72 L(已折算到标准状况),将该气体通入装有足量灼热CuO的硬质玻璃管中充分反应,测得硬质玻璃管中固体质量减轻6.4 g。则Ca3N2的纯度为_________(用百分数表示,保留一位小数)(注:氨气能被灼热氧化铜氧化,生成一种对环境无污染气体)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com