
【题目】下列因素中,对发生在溶液中且无气体参加的反应的速率不产生显著影响的是( )
A. 浓度B. 压强C. 温度D. 反应物的性质
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:

CH3CH2CH2CH2OH![]() CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为___________________________。
(2)加入沸石的作用是________________________________________________。
若加热后发现未加沸石,应采取的正确方法是______________________________。
(3)上述装置图中,D仪器的名称是________,E仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______________层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是__________________________________、__________________________________________________。
(7)本实验中,正丁醛的产率为________%(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取氢氧化钠的工艺流程示意图如下:
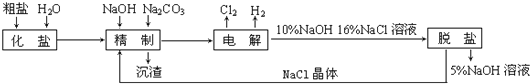
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为_______________________,与电源负极相连的电极附近,溶液pH值_____________(选填:不变、升高或下降)
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为_______________________,_______________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是___________(选填a、b、c,多选扣分)
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为____________(选填a,b,c多选扣分)
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__________、冷却、___________(填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和![]() ,相应的化学方程式为______________________。
,相应的化学方程式为______________________。
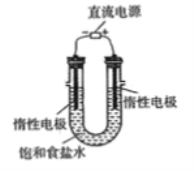
(7)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2____________(填“>”、“=”或“<”)2L,原因是_____________________。
(8)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4→ZnSO4+H2↑、MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
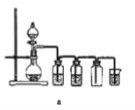
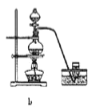
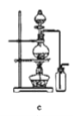
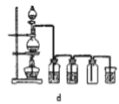
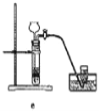
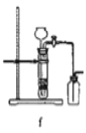
据此,制备并收集干燥、纯净Cl2的装置是______(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积为2L的密闭容器中,发生如下反应:N2+ 3H2 ![]() 2NH3。
2NH3。
(1)若反应进行5min时,测得n(N2) = 1.8mol,n(NH3) = 0.4mol。
计算:①a的值; ②用H2浓度的变化表示的反应速率。
(2)反应达平衡时,混合气体的总物质的量为5.0mol,其中NH3的含量(体积分数)为40%。
计算:上述温度下该反应的化学平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的氢气在氯气中燃烧,所得混合物用200mL 3.00mol∕L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.15mol。(忽略溶液体积的变化)
(1)求原NaOH溶液的质量分数(保留两位小数);___________
(2)所得溶液Cl-中的物质的量浓度;__________
(3)所用氯气和参加反应的氢气的物质的量之比。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:在Na2SO3溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的BaCl2溶液,现象是_________,请结合离子方程式,运用平衡原理进行解释_____________________。
II:等体积等物质的量浓度的 NaClO溶液与Na2SO3溶液混合后,溶液显______性。此时溶液中浓度相等的微粒是___________________________________________。
III:已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11,含H2S尾气用足量的Na2CO3溶液来吸收。写出离子反应方程式。____________,常温时,等体积等浓度的Na2S和Na2CO3溶液的离子总数:N前___N后(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图装置可以制备四氯化锡(部分夹持装置已略去)。

有关信息如下表:
化学式 |
|
|
摩尔质量( | 190 | 261 |
熔点 | 246 | -33 |
沸点 | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)装置甲中仪器![]() 的名称为_____________。
的名称为_____________。
(2)用装置甲制取氯气,![]() 被还原为
被还原为![]() ,该反应的离子方程式为___________。
,该反应的离子方程式为___________。
(3)将如图装置连接好,先检查装置气密性,再慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热装置丁,锡熔化后适当增大氯气流量,继续加热装置丁,此时继续加热装置丁的目的是:①促进氯气与锡反应;②_________________________。
(4)如果缺少装置乙,可能发生的副反应的化学方程式为_______________;装置己的作用是______(填字母代号)。
A.除去未反应的氯气,防止污染空气
B.防止空气中![]() 气体进入装置戊
气体进入装置戊
C.防止水蒸气进入装置戊的试管中使产物水解
D.防止空气中![]() 进入装置戊的试管中使产物氧化
进入装置戊的试管中使产物氧化
(5)某同学认为丁装置中的反应可能产生![]() 杂质,以下试剂中可用于检测是否产生
杂质,以下试剂中可用于检测是否产生![]() 的是______(填字母代号)。
的是______(填字母代号)。
A. ![]() 溶液 B.
溶液 B. ![]() 溶液(滴有
溶液(滴有![]() 溶液) C.
溶液) C. ![]() 溶液
溶液
(6)反应中用去锡粒![]() ,反应后在戊装置的试管中收集到
,反应后在戊装置的试管中收集到![]() ,则
,则![]() 的产率为_____(保留3位有效数字)。
的产率为_____(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验表明新型钠离子聚合物电池正负极材料均表现出较快的电极反应动力学,使得电池具备高功率性能。其放电时的工作原理如图,下列说法正确的是

A. 放电时,高聚物发生还原反应
B. 充电时,阳极的电极反应式为 3I- +2e-=I3-
C. 充电时,电极A接电源负极
D. 放电时,当转移0.5 mol电子,NaI溶液中增加0.5NA个Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c1∶c2=1∶3
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等
D. c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com