
【题目】下列化学反应的产物中,存在同分异构体的是( )
A. CH3CH2CH2Br在碱性溶液中水解
B. 甲苯在催化剂作用下与Cl2发生苯环上的取代反应
C. ![]() 与NaOH的醇溶液共热反应
与NaOH的醇溶液共热反应
D. ![]() 在催化剂存在下与H2完全加成
在催化剂存在下与H2完全加成
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,35.5g氯气的体积是___L,将其与氢气完全化合生成氯化氢的物质的量是___mol,将生成的气体制成1L溶液,溶质的物质的量浓度是___mol/L,将此溶液取出20mL加蒸馏水稀释成200mL溶液,此稀稀后的溶液中溶质的物质的量浓度是___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某核素 ZAX可形成HmX型氢化物,则a g HmX 含有 ( )
A.![]() (A-Z+m)mol中子B.
(A-Z+m)mol中子B.![]() mol电子
mol电子
C.![]() (Z+m) mol质子D.
(Z+m) mol质子D.![]() mol HmX分子
mol HmX分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢.
(1)A的结构简式为___________; A中的碳原子是否都处于同一平面?____(填“是”或“不是”);
(2) 在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体.

反应②的化学方程式为__________________________;E2的结构简式是___________________;④、⑥的反应类型依次是________________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料.工业上提取铝的工艺流程如下:
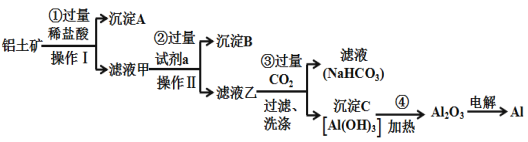
(1)沉淀A的化学式是_________,试剂a的化学式为______________;
(2)步骤③中通入过量CO2,产生沉淀C的离子方程式为______________________________________;
(3)Al2O3中所含的化学键的类型为___________________;
(4)工业上用电解熔融Al2O3的方法制备金属铝,其阳极反应式为______________________________;
(5)在生活中,常利用Al与Fe2O3间的铝热反应来进行焊接钢轨。除了Fe2O3,铝粉还可以与很多金属氧化物组成铝热剂。下列氧化物中不能与铝粉组成铝热剂的是(___________)
a MgO b V2O 5 c Fe3O4 d MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
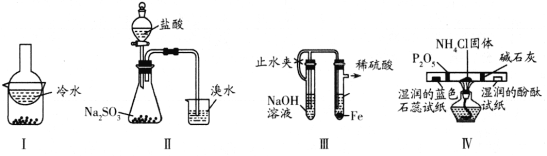
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)含有 6.02×1023个 H 的H2O,其物质的量是_______;1L 1 mol·L -1Na2SO4溶液中 含有_____个 Na+、_____个 SO42- 。
(2)______mol H2O 中含有的氧原子数与 1.5 mol CO2中含有的氧原子数相等。
(3)将等物质的量的 NH3 和 CH4 混合,混合气体中 NH3 和 CH4 的质量之比为 ______。
(4)要使 NH3和 CH4含相同数目的H原子,则 NH3和 CH4的物质的量之比为_____。
(5)标准状况下,密度为 0.75g·L -1的 NH3和 CH4 组成的混合气体中,NH3的体积分数为________,该混合气体对氢气的相对密度为________。
(6)已知 a g A 和 b g B 恰好完全反应生成 0.2 mol C 和 d g D,则 C 的摩尔质量为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20g/3。
⑴此浓盐酸的物质的量浓度是多少?_______________(列式计算)
⑵配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL? ______________(列式计算)
⑶用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号):_____________________ 。
①计算②装瓶③用50mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如图:
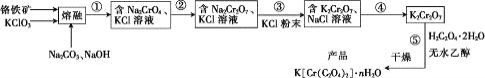
回答下列问题:
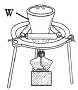
(1)“熔融”的装置如图,坩埚W的材质可以是________(填“铁”“陶瓷”或“玻璃”);FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为_______________。
(2)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等,步骤①的具体步骤为水浸,过滤,调pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为________,“调pH为7~8,加热煮沸半小时”的目的是__________。
(3)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为________。
(4)步骤④包含的具体操作有____,经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)
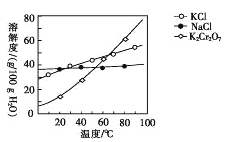
(5)步骤⑤需往两种固体混合物中加入一滴水及少量酒精研磨,所用的硅酸盐质仪器的名称是________。
(6)采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com