
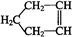
 可简写为:
可简写为: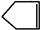
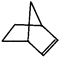
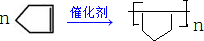 ,故答案为:
,故答案为: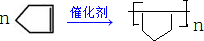 .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、0.02mol/(L?min) |
| B、0.04mol/(L?min) |
| C、0.08mol/(L?min) |
| D、0.8mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
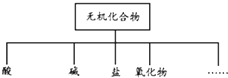 无机化合物可根据其组成和性质进行分类.
无机化合物可根据其组成和性质进行分类.| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ② |
③ ④Ba(OH0)2 |
⑤Na2CO3 ⑥ |
⑦CO2 ⑧Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
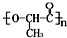 是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋.请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)
是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋.请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)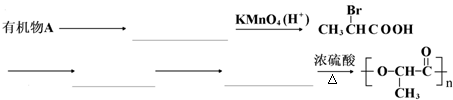
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16gO2中含有的氧分子数为NA |
| B、1mol镁原子中含有的电子数为NA |
| C、常温常压下,11.2L H2中含有的氢分子数为0.5NA |
| D、1L 1mol/L BaCl2溶液中含有的钡离子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com