
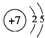 ,
,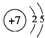 ;
; ,
, ;
;

 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
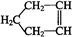 可简写为:
可简写为: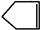
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
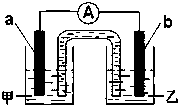 一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-=2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-=2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
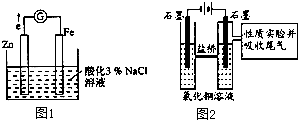
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B、放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C、充电时阳极反应为:Fe(OH)3-3e-+5 OH-=FeO42-+4H2O |
| D、放电时正极附近溶液的碱性减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com