
【题目】由铜、锌和稀盐酸组成的原电池中,铜是极,发生反应,电极反应式是;锌是极,发生反应,电极反应式是 .
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中正确的是
A. 铜片插入硝酸银溶液中:Cu + Ag+ ![]() Cu2+ + Ag
Cu2+ + Ag
B. 在澄清石灰水中通入足量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
C. 碳酸镁跟醋酸反应:MgCO3+2H+ ![]() Mg2+ +H2O+CO2↑
Mg2+ +H2O+CO2↑
D. 铁跟稀硫酸反应: Fe+2H+ ![]() Fe2+ + H2↑
Fe2+ + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.H2与D2互为同素异形体B.符合CnH2n+2且n不同的烃不一定属于同系物
C.CH2Cl2有2种同分异构体D.乙醇能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
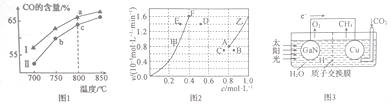
【题目】“低碳经济”备受关注,CO2的捕集、利用与封存成为科学家研究的重要课题。将一定量的CO2(B)和CH4(g)通入一恒容密闭容器中发生反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。回答下列问题:
2CO(g)+2H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41 kJ·mol-1
则反应CO2(g)+CH4(g)![]() 2CO(g) +2H2(g)的△H =___________。
2CO(g) +2H2(g)的△H =___________。
(2)其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下,反应经过相同时间时,体系中CO含量随反应温度的变化如图1所示。
①在a点与c点对应的反应条件下,反应继续进行一段时间后达到平衡,平衡常数K(a 点)________K(c点 )( 填“>”“ <”或“=”)。
②b点CO含量低于c点的原因是____________________。
(3)为了探究反应:CO2(g) +CH4(g)![]() 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线____________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为____________(填字母)。
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线____________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为____________(填字母)。
(4)将足量CO2通入饱和氨水中可得氮肥NH4HCO3。在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka2=4×10-11)。
NH3·H2O+H2CO3的平衡常数K=_________(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka2=4×10-11)。
(5)科学家用氮化镓材料与铜组装成如图3所示的人工光合系统,利用该装置成功地实现了用CO2和H2O合成CH4。。氮化镓(GaN)表面发生__________(填“氧化”或“还 原”)反应,铜电极上的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列实验仪器和实验操作的有关问题。


(1)图A中试管夹的作用是______________________。
(2)指出图B中的错误操作是____________________________________。
(3)图C、D是某同学配制50 g质量分数为6%的氯化钠溶液时,在称量和量取两个操作步骤中出现的情况:
①如图C所示:在称量氯化钠的操作过程中,发现指针偏右,则继续进行的操作是______________,至天平平衡。
②如图D所示,量取水时,仰视读数,所得溶液中溶质的质量分数会______________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入2.0 mol X,反应X(g) ![]() Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(Y)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法不正确的是
A. 反应在前250 s的平均速率为v(Y)=0.000 8 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(Y)=0.21 mol·L-1,则反应的ΔH>0
C. 相同温度下,起始时向容器中充入4.0 mol Y、4.0 mol Z,达到平衡时,则此反应的化学平衡常数为1/20
D. 相同温度下,若起始时向容器中充入2.0 mol X、0.40 mol Y和0.80 mol Z,则达到平衡前v(正)>v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com